Entropía
De Laplace
(→Reacciones químicas) |
(→Reacciones químicas) |
||
| Línea 130: | Línea 130: | ||
<center><math>\Delta S^0_\mathrm{reaccion}=S_\mathrm{productos}^0-S_\mathrm{reactivos}^0</math></center> | <center><math>\Delta S^0_\mathrm{reaccion}=S_\mathrm{productos}^0-S_\mathrm{reactivos}^0</math></center> | ||
| - | Lo que quiere decir esta descomposición | + | Lo que quiere decir esta descomposición en tres sumas es que, para estudiar una reacción a una cierta presión y temperatura, aprovechamos el que la entropía es una función de estado. En lugar de calcular la diferencia directamente a dicha <math>p</math> y <math>T</math>, lo que hacemos es imaginarnos que llevamos los reactivos, sin reaccionar, al estado estándar. Luego efectuamos la reacción en el estado estándar, aprovechando los valores tabulados, y por último llevamos los productos al estado original. |
==Entropía y exergía== | ==Entropía y exergía== | ||
[[Categoría:Segundo Principio]] | [[Categoría:Segundo Principio]] | ||
Revisión de 08:48 16 may 2009
Contenido |
1 Introducción
2 Desigualdad de Clausius
La desigualdad de Clausius establece que, para todo proceso cíclico
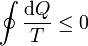
donde cada uno de los símbolos posee la siguiente interpretación
-
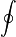
- La integral con el circulito se denomina “integral cerrada” y quiere decir que la suma se efectúa sobre una curva que se cierra sobre sí misma
- dQ
- representa la cantidad de calor diferencial que entra en el sistema desde un foco situado a la temperatura T. A lo largo de un ciclo habrá ocasiones en que su valor sea positivo y veces en que será negativo, según el sistema absorba o ceda calor.
- T
- es la temperatura del foco que cede el calor. No es la temperatura del sistema. Es más, para empezar la temperatura del sistema probablemente ni estará definida. En algunos puntos tendrá un valor y en otros será distinto. En el caso de que sí tenga un valor definido, T', este valor será menor que el exterior cuando el calor entra (ya que si no, no entraría), y será mayor que el exterior cuando el calor sale. Solo en un proceso reversible T' se diferenciará una cantidad infinitesimal de T (ya que si no, no sería reversible).
- La desigualdad de Clausius no nos dice cuanto vale la integral, en general. Solo nos informa de sus signo. Pero al hacerlo nos proporciona un criterio para clasificar los posibles procesos:
- Si la integral es negativa: el proceso es irreversible.
- Si la integral es nula: el proceso es reversible.
- Si la integral es positiva: el proceso es imposible.
3 Definición de entropía
3.1 Variación de entropía
Para un ciclo reversible, la desigualdad de Clausius se transforma en una igualdad.
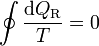 (ciclo reversible)
(ciclo reversible)Consideremos ahora un ciclo reversible que pasa por dos estados A y B. Podemos suponer este ciclo como formado por dos caminos C y C' que van de A a B, siendo uno de ellos (C') recorrido de B a A. Para este ciclo la igualdad se convierte en
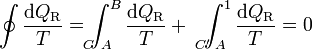
y, despejando

Ahora bien, por ser los caminos reversibles, la integral de B a A por C' es igual a la integral de A a B por el mismo camino C', cambiada de signo. Físicamente, esto quiere decir que si vamos de B a A por C' y en un cierto paso entra en el sistema una cantidad de calor dQR, si recorremos el camino en sentido contrario, cuando lleguemos al mismo sitio la misma cantidad de calor saldrá del sistema (es decir, que en el camino inverso entra − dQR). Por tanto
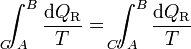
Puesto que este resultado puede extenderse a cualquier otro camino reversible que conecte A con B, concluimos que el valor de la integral es independiente del camino y por tanto solo depende de los estados inicial y final. Por ello, su valor es igual a la diferencia de una cierta función de estado que denominamos entropía
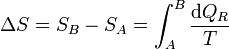
o, en forma diferencial
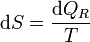
Dicho con palabras: el incremento diferencial de entropía entre dos estados vecinos es igual la cantidad de calor que entra reversiblemente entre dichos estados dividida por la temperatura a la que se intercambia el calor. Puesto que estamos hablando de procesos reversibles no es necesario distinguir entre la temperatura del ambiente T y la del sistema T', ya que en un proceso reversible ambas deben diferenciarse como mucho en una cantidad infinitesimal.
3.2 Entropía absoluta
La definición anterior sólo nos da la diferencia de entropía entre dos estados, no su valor absoluto. Es más, hemos afirmado, sin probarlo, que el resultado de la integral es una diferencia de los valores de la entropía en B y en A. ¿Por qué la diferencia y no, por ejemplo, el cociente f(B) / f(A)?
Podemos definir la entropía respecto a un cierto estado de referencia, O, como la integral
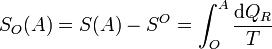
Este estado O, por definición, tendrá entropía nula respecto a sí mismo (SO(O) = 0). Puesto que O es un estado fijo, esta integral solo depende de A.
Consideremos ahora la integral entre A y B
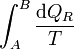
Puesto que podemos elegir el camino que queramos para ir de A a B, tomamos uno que pase por O. Entonces
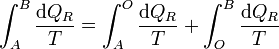
y puesto que los caminos son reversibles
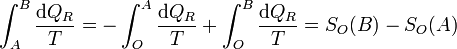
Luego efectivamente sí resulta la diferencia entre la función evaluada en B y la misma función evaluada en A.
Realmente esta definición lo que nos da es de nuevo una diferencia, pero respecto a un estado estándar, que puede ser establecido por convenio. La IUPAC recomienda definir el estado estándar como el correspondiente a una presión de 100 kPa (0.9869 atm) y 0°C (aunque la mayoría de las tablas dan la entropía del estado estandar a 25°C).
El cambio de estado de referencia lo que añade es una constante a la entropía. Por ello, si lo que queremos calcular es la variación de entropía entre dos estados A y B, nos es indiferente el estado de referencia que tomemos, nos basta con hacer la integral directamente por un camino reversible que vaya de A a B.
Cuando se formula el Tercer Principio de la termodinámica, que establece que la entropía de un cristal perfecto, a 0 K es nula, se da un verdadero valor absoluto a la entropía, pues fija un estado de referencia universal.
4 Principio del aumento de entropía
4.1 Ciclo parcialmente irreversible
Supongamos ahora un ciclo irreversible formado por un camino irreversible que lleva del estado 1 al 2 y vuelve por un camino reversible. En este caso tenemos la desigualdad
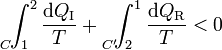
que equivale a decir que la integral por el camino reversible es mayor que por el irreversible
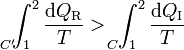
Pero la integral por el camino reversible es justamente la diferencia entre la entropía inicial y la final. Por tanto
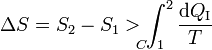
Podemos transformar esta desigualdad en una igualdad introduciendo la producción de entropía Sgen
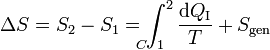
Por tanto la desigualdad de Clausius equivale a decir que la producción de entropía en un sistema es siempre positiva (en un proceso irreversible) o nula (en uno reversible). Nunca negativa.
4.2 Principio del aumento de entropía
En el caso particular de un sistema aislado, ningún calor entra o sale del sistema, dQ = 0 y por tanto
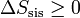 (sistema aislado)
(sistema aislado)esto es, para un sistema aislado la entropía es una función creciente en todo proceso real. Sólo si el proceso es reversible la entropía permanece constante.
Si consideramos el “universo” como el conjunto del sistema más la parte del ambiente con la que intercambia calor o trabajo, podemos tratar al universo como un sistema aislado, con lo que obtenemos el principio del aumento de entropía:
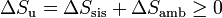
esto es, en todo proceso real la entropía aumenta (si el proceso es irreversible) o permanece estacionaria (si es reversible), pero nunca disminuye.
Obsérvese que en un proceso real es posible que la entropía del sistema disminuya (es lo que ocurre normalmente si se enfría), pero esa disminución debe ser compensada por un aumento en el ambiente, que supere con creces dicha disminución.
5 Relación con otros enunciados del segundo principio
6 Entropía y trabajo perdido
7 Ejemplos
7.1 Máquina térmica
7.2 Inmersión en un baño térmico
7.3 Cambio de fase
7.4 Gas ideal
7.5 Mezcla de gases
7.6 Reacciones químicas
Cuando se analiza una reacción química lo que se suele hacer es
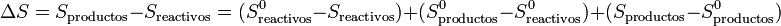
siendo S0 las entropías medidas y tabuladas en el estado estándar. La segunda diferencia representa la variación de la entropía en la reacción en el estado estándar
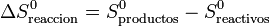
Lo que quiere decir esta descomposición en tres sumas es que, para estudiar una reacción a una cierta presión y temperatura, aprovechamos el que la entropía es una función de estado. En lugar de calcular la diferencia directamente a dicha p y T, lo que hacemos es imaginarnos que llevamos los reactivos, sin reaccionar, al estado estándar. Luego efectuamos la reacción en el estado estándar, aprovechando los valores tabulados, y por último llevamos los productos al estado original.





