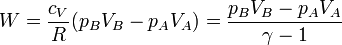Trabajo en una y en dos etapas
De Laplace
(→En una sola etapa) |
(→En una sola etapa) |
||
| Línea 25: | Línea 25: | ||
<center><math>W = \Delta U = n\,c_V\,\Delta T = n\,c_V(T_B-T_A)</math></center> | <center><math>W = \Delta U = n\,c_V\,\Delta T = n\,c_V(T_B-T_A)</math></center> | ||
| + | |||
| + | Sustituyendo la ecuación de estado de los gases ideales | ||
| + | |||
| + | <center><math>W = \frac{c_V}{R}(p_BV_B-p_AV_A)=\frac{p_BV_B-p_AV_A}{\gamma-1}</math></center> | ||
===En dos etapas=== | ===En dos etapas=== | ||
Revisión de 11:25 23 abr 2009
Contenido |
1 Enunciado
Un gas diatómico se comprime adiabáticamente, de modo cuasiestático, desde 1 atm hasta 25 atm, siendo la temperatura inicial t = 25 °C. La compresión puede realizarse en una sola etapa o bien en dos: desde 1 atm hasta 5 atm primero, y desde 5 atm hasta 25 atm después, dejando que el gas se enfríe a presión constante hasta volver a su temperatura inicial entre las dos etapas.
- Dibuje los dos procesos en el diagrama PV .
- Determine cual de los dos procesos exige realizar un menor trabajo sobre el sistema.
Nota: No es necesario incluir el proceso intermedio de compresión a presión constante en el balance del trabajo realizado.
2 Introducción
Este problema pretende introducir algunos aspectos de la irreversibilidad que presenta los procesos termodinámicos reales. Para ello comparamos dos procesos con algunas características comunes:
- En el primer proceso comprimimos un gas ideal de forma adiabática desde 1 a 25 atm. Esto correspondería a tener un cilindro con un pistón y a que presionáramos el pistón de forma lo suficientemente rápida como para que al gas no le de tiempo a intercambiar calor con el ambiente. En este caso todo el trabajo que realizamos sobre el sistema se invertirá en aumentar la energía interna.
- En el segundo proceso, partimos del mismo estado inicial y subimos de nuevo hasta 25 atm pero en lugar de realizar la compresión de una vez, paramos a descansar cuando vamos por 5&atm;. Durante el periodo de descanso, al gas le da tiempo a enfriarse y volver a la temperatura inicial, que es la del ambiente. Esto lo hace cediendo calor y reduciendo la energía interna. Cuando volvemos a comprimir lo hacemos sobre un gas más frio que en el primer proceso, por lo que el trabajo del segundo paso será diferente.
En el balance de trabajo no incluiremos el trabajo del paso intermedio de enfriamiento porque "ocurre solo", esto es, se trata de un proceso espontáneo en el que el sistema cede calor al ambiente, y como tal irreversible. Al agente que está comprimiendo el pistón le basta con mantener la presión en este proceso.
3 Diagrama PV
4 Trabajo realizado sobre el sistema
4.1 En una sola etapa
Consideremos el proceso adiabático que lleva del estado inicial A al final, B.
En un proceso adiabático el sistema no intercambia calor con el ambiente. De acuerdo con el primer principio de la termodinámica, el incremento en la energía interna se debe exclusivamente al trabajo realizado sobre el sistema. A su vez, la energía interna de un gas ideal depende exclusivamente de su temperatura, por lo que
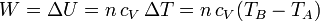
Sustituyendo la ecuación de estado de los gases ideales