Caso práctico de ciclo Otto
De Laplace
| Línea 95: | Línea 95: | ||
con lo cual el calor liberado en la combustión es aproximadamente | con lo cual el calor liberado en la combustión es aproximadamente | ||
| - | <center><math>Q_\mathrm{in}= mq=1.92\,\mathrm{g}\times 800\,\frac{ | + | <center><math>Q_\mathrm{in}= mq=1.92\,\mathrm{g}\times 800\,\frac{\mathrm{J}}{\mathrm{g}} = 1540\,\mathrm{J}</math></center> |
Puesto que no se realiza trabajo en este paso, este calor es igual al incremento de la energía interna | Puesto que no se realiza trabajo en este paso, este calor es igual al incremento de la energía interna | ||
Revisión de 10:58 20 abr 2016
Contenido |
1 Enunciado
Suponga un motor de gasolina de 1400 cm³ de cilindrada que se puede modelar mediante un ciclo Otto ideal con una relación de compresión de 8. Al inicio de la fase de compresión, el aire está a 100 kPa y 17°C. En la combustión se añaden 800 kJ/kg de calor. Determine la temperatura y la presión máximas que se producen en el ciclo, la salida de trabajo neto y el rendimiento de este motor.
Si este motor trabaja a 3000rpm, ¿cuánto es la potencia generada?
2 Estados del ciclo
El ciclo Otto ideal sirve para modelar el comportamiento de un motor de gasolina y está formado por dos isócoras y dos adiabáticas.
Estos cuatro procesos se pueden representar por segmentos rectos o curvos en un diagrama pV. Los vértices corresponden a 4 estados de equilibrio de forma que el proceso es A→B→C→D→A.
Denominaremos estado A al que tiene el gas antes de la compresión.
En este estado la temperatura es de 290 K y la presión es de 100 kPa.
El volumen inicial lo obtenemos de que conocemos la cilindrada
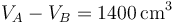
y la relación de compresión
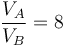
Despejando y sustituyendo obtenemos que

Con esto ya tenemos el punto de partida
| Estado | p (kPa) | T (K) | V (cm³) |
|---|---|---|---|
| A | 100 | 290 | 1600 |
Para ir del estado A al B se realiza una compresión adiabática. Como suponemos que es cuasiestática, podemos aplicar la ley de Poisson
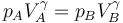
lo que nos permite hallar la presión en B
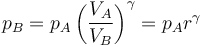
lo que da
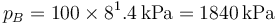
Conocidas la presión y el volumen, tenemos la temperatura por la ley de los gases ideales
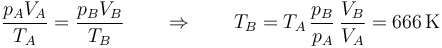
lo que nos da el segundo vértice
| Estado | p (kPa) | T (K) | V (cm³) |
|---|---|---|---|
| A | 100 | 290 | 1600 |
| B | 1840 | 666 | 200 |
Para el tercer vértice, C, tenemos en primer lugar que el volumen no cambia
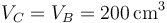
para hallar la nueva temperatura debemos tener en cuenta el calor aportado por la combustión. El poder calorífico de la mezcla es de 800kJ/kg. La masa de mezcla que tenemos es aproximadamente la del aire, siendo su valor
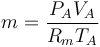
siendo Rm la constante del gas, que para el aire vale
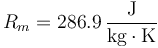
Esto nos da una masa
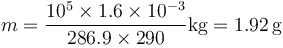
con lo cual el calor liberado en la combustión es aproximadamente
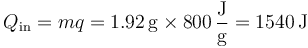
Puesto que no se realiza trabajo en este paso, este calor es igual al incremento de la energía interna
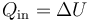
Cuando el cambio de temperatura es muy grande, la relación entre U y T es una función complicada, por lo que el procedimiento correcto es ir a una tabla y ver que temperatura corresponde a una determinada energía.
Si hacemos la aproximación de capacidades caloríficas constantes, podemos estimar la temperatura final a partir de
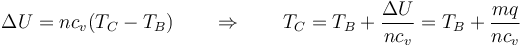
puesto que m/n es el peso molecular (28.96 g/mol para el aire) y cv = 5R / 2 para el aire queda
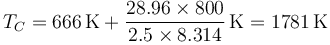
Mediante la ley de los gases ideales hallamos la presión
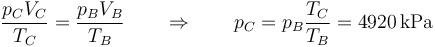
lo que nos da la siguiente fila de la tabla
| Estado | p (kPa) | T (K) | V (cm³) |
|---|---|---|---|
| A | 100 | 290 | 1600 |
| B | 1840 | 666 | 200 |
| C | 4920 | 1780 | 200 |





