Caso extremo de ciclo Diesel
De Laplace
(→Valores numéricos) |
(→Valores numéricos) |
||
| Línea 101: | Línea 101: | ||
<center><math>p_A=100,\mathrm{kPa}</math>{{qquad}}{{qquad}}<math>V_A=1900\mathrm{cm}^3</math>{{qquad}}{{qquad}}<math>T_A=290\,\mathrm{K}</math></center> | <center><math>p_A=100,\mathrm{kPa}</math>{{qquad}}{{qquad}}<math>V_A=1900\mathrm{cm}^3</math>{{qquad}}{{qquad}}<math>T_A=290\,\mathrm{K}</math></center> | ||
| + | ===Presión, volumen y temperatura=== | ||
El número de moles de gas, que será una constante en el ciclo, lo obtenemos aplicando la ley de los gases ideales | El número de moles de gas, que será una constante en el ciclo, lo obtenemos aplicando la ley de los gases ideales | ||
| Línea 154: | Línea 155: | ||
|} | |} | ||
</center> | </center> | ||
| + | |||
| + | ===calor y trabajo=== | ||
==Entropía== | ==Entropía== | ||
==Trabajo perdido== | ==Trabajo perdido== | ||
[[Categoría:Problemas del segundo principio de la termodinámica]] | [[Categoría:Problemas del segundo principio de la termodinámica]] | ||
Revisión de 18:50 15 jun 2009
Contenido |
1 Enunciado
Una máquina térmica funciona funciona con aire (gas ideal) según el siguiente proceso:
- El gas contenido en una cámara se comprime adiabáticamente de forma reversible desde un volumen máximo VA hasta un volumen VB, siendo la razón de compresión r = VA / VB.
- A partir de ahí, el gas se pone en contacto con un foco térmico y se calienta a presión constante hasta un estado C, cuyo volumen es igual al inicial.
- Acto seguido, el gas se enfría a volumen constante hasta que la temperatura retorna a su valor inicial.
- Halle el calor absorbido y cedido por el gas durante el ciclo, así como el trabajo realizado sobre el sistema. Demuestre que el rendimiento de este ciclo es igual a
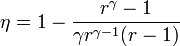
- Para el caso concreto de aire con
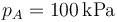 ,
, 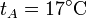 ,
, 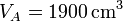 y r = 3, ¿cuánto valen las temperaturas y presiones en B y C? ¿Y el calor absorbido, el cedido y el trabajo realizado? ¿Y el rendimiento?
y r = 3, ¿cuánto valen las temperaturas y presiones en B y C? ¿Y el calor absorbido, el cedido y el trabajo realizado? ¿Y el rendimiento? - Supongamos que el calentamiento se produce a base de poner en contacto el gas con un foco a temperatura constante TC, y el enfriamiento mediante el contacto con el ambiente a TA. ¿Cuánto vale la variación de entropía en el sistema y en el universo en cada paso? ¿Cuál es la variación neta de entropía del universo?
- ¿Cuánto vale el trabajo perdido en este ciclo si lo comparamos con el máximo posible para el mismo calor absorbido con las temperaturas de trabajo TA y TC?
2 Calor, trabajo y rendimiento
2.1 Calor absorbido
De los tres procesos que tienen lugar en el ciclo en uno de ellos, la compresión adiabática, no se intercambia calor; en otro, el calentamiento isóbara, el sistema absorbe calor, y en el tercero, el enfriamiento isócoro, el sistema cede calor.
Al ser el proceso de calentamiento uno a presión constante entre las temperaturas TB y TC, el calor absorbido es
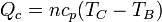
2.2 Calor cedido
El calor se cede en un proceso a volumen constante, entre las temperaturas TC y TA, por lo que vale
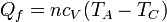
puesto que TA < TC, este calor es negativo, como corresponde a que este calor sale del sistema hacia el ambiente.
2.3 Trabajo
Podemos calcular el valor neto del trabajo realizado sobre el sistema empleando el Primer Principio de la termodinámica, ya que en un proceso cíclico la energía interna al final es la misma que al principio
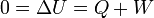


Podemos calcular este valor a partir del trabajo realizado sobre el sistema en cada proceso:
- Compresión adiabática
- En este proceso no se intercambia calor, por lo que el trabajo es igual al incremento de energía interna
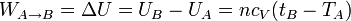
- Calentamiento a presión constante
- El trabajo cuando la presión es constante es igual a esta presión por el incremento de volumen, cambiado de signo
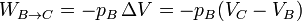
- Podemos poner esto en función de la temperatura, usando la ecuación de los gases ideales
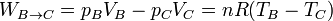
- Este trabajo es negativo ya que en esta expansión es realmente el sistema el que trabaja sobre el ambiente.
- Enfriamiento a volumen constante
- Al no desplazarse las paredes del sistema, aquí no se realiza trabajo mecánico

Sumando las tres contribuciones obtenemos el trabajo total
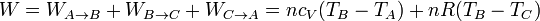
Para ver que este resultado coincide con el que obtuvimos antes, hacemos uso de la ley de Mayer
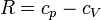
 W = ncV(TB − TA) + n(cp − cV)(TB − TC) = ncp(TB − TC) + ncV(TC − TA) = − Qc − Qf
W = ncV(TB − TA) + n(cp − cV)(TB − TC) = ncp(TB − TC) + ncV(TC − TA) = − Qc − Qf2.4 Rendimiento
El rendimiento del ciclo es igual al cociente entre el trabajo neto realizado por el sistema y el calor absorbido durante el ciclo
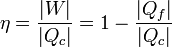
Sustituyendo las expresiones obtenidas anteriormente
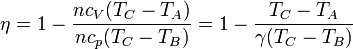
Para expresar el rendimiento en función de la razón de compresión r = VA / VB observamos que, por ser B→C un proceso a presión constante se cumple la ley de Charles
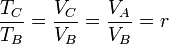

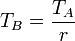
En el proceso a volumen constante, la proporcionalidad se da entre la presión y la temperatura

La relación de presiones pB / pA no es independiente de la relación de compresión, sino que están relacionados por la condición de que el proceso A→B es adiabático y reversible
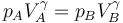

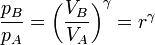
Por tanto tenemos la relación
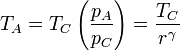
Llevando esto a la expresión del rendimiento
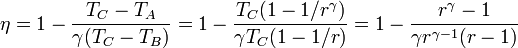
Comparando este resultado con el de un ciclo Diesel vemos que esta expresión es idéntica a la que se obtiene para ese ciclo si hacemos la relación de combustión rc igual a la relación de compresión. En realidad, el ciclo descrito en este problema es en realidad un ciclo Diesel ideal, en el cual una de las adiabáticas se ha reducido a un punto.
3 Valores numéricos
Se trata ahora de hallar todos los valores anteriores, y algunos más, para un caso particular, con condiciones
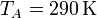
3.1 Presión, volumen y temperatura
El número de moles de gas, que será una constante en el ciclo, lo obtenemos aplicando la ley de los gases ideales
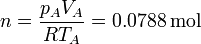
Por la relación de compresión tenemos el volumen de B; el de C es igual al de A,
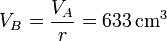

La presión en B (y C) la obtenemos de la ecuación para una adiabática reversible que obtuvimos antes
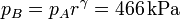
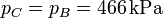
Aquí hemos usado el valor γ = 1.4, propio del aire.
La temperatura en B la hallamos por aplicación de la ley de los gases ideales
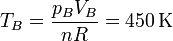
También se puede obtener esta temperatura empleando la relación para un proceso adiabático
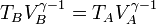

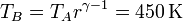
la temperatura en C la obtenemos de la ley de Charles

Reuniendo todos estos resultados en una tabla nos queda
| A | B | C | |
|---|---|---|---|
| p(kPa) | 100 | 466 | 466 |
| V(cm3) | 1900 | 633 | 1900 |
| T(K) | 290 | 450 | 1350 |





