Entropía de una mezcla de gases
De Laplace
(→Incremento de entropía) |
(→Incremento de entropía) |
||
| Línea 84: | Línea 84: | ||
Lo mismo ocurre con la presión ''total'' ('''no''' con la parcial), ya que inicialmente ambos se encontraban a la misma y al romper la membrana se redistribuyen las moléculas, pero el número de moles total y el volumen total sigue siendo el mismo. | Lo mismo ocurre con la presión ''total'' ('''no''' con la parcial), ya que inicialmente ambos se encontraban a la misma y al romper la membrana se redistribuyen las moléculas, pero el número de moles total y el volumen total sigue siendo el mismo. | ||
| - | <center><math>p_{i0}=p</math></center> | + | <center><math>p_{i0}=p\,</math></center> |
Las presiones parciales sí se ven reducidas pues cada gas pasa a ocupar el volumen total, con el mismo número de moles. las presiones parciales serán | Las presiones parciales sí se ven reducidas pues cada gas pasa a ocupar el volumen total, con el mismo número de moles. las presiones parciales serán | ||
| Línea 96: | Línea 96: | ||
Aplicando la ley de los gases ideales | Aplicando la ley de los gases ideales | ||
| - | <center><math>\Delta S = -\sum_i\frac{p_iV}{T}\ln(x_i) = -\frac{ | + | <center><math>\Delta S = -\sum_i\frac{p_iV}{T}\ln(x_i) = -\frac{pV}{T}\left(x_{O_2}\ln(x_{O_2})+x_{H_2}\ln(x_{H_2})\right)</math></center> |
| + | |||
| + | En nuestro caso, las fracciones molares de los dos gases son la misma: un 50%, ya que a igualdad de presión, volumen y temperaturas iniciales les corresponde el mismo número de moles (nótese que no necesitamos calcular cuántos son estos moles). | ||
| + | |||
| + | <center><math>x_{O_2}=x_{H_2} = \frac{1}{2}</math>{{tose}}<math>\Delta S = -\frac{1\,\mathrm{atm}\cdot 2\,\mathrm{l}}{298\,\mathrm{K}}(2\times(0.5\ln(0.5))\cdot\frac{101.325\,\mathrm{J}{1\,\mathrm{atm}\cdot\mathrm{l}} = 0.471\,\frac{\mathrm{J}}{\mathrm{K}}</math></center> | ||
| + | |||
| + | Vemos que la entropía aumenta, por lo que este proceso es irreversible. | ||
| - | |||
[[Categoría:Problemas del segundo principio de la termodinámica]] | [[Categoría:Problemas del segundo principio de la termodinámica]] | ||
Revisión de 23:08 28 abr 2009
Contenido |
1 Enunciado
Un recipiente de 2.00 l tiene una barrera que lo divide por la mitad. Una mitad contiene H2 y la otra O2. Ambos gases se encuentran a temperatura ambiente y presión atmosférica. Se retira la barrera de separación, permitiendo que los gases se mezclen. ¿Cuál el aumento de entropía del sistema?
2 Entropía de un gas ideal
2.1 Expresión en función de T y V
Para un gas ideal puro, podemos calcular el incremento diferencial de entropía a partir de la definición
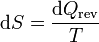
A su vez, el diferencial de calor reversible puede hallarse mediante el primer principio de la termodinámica
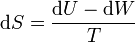
Para un gas ideal sabemos que
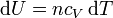
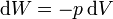

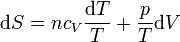
Sustituyendo la ecuación de estado del gas ideal
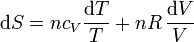
Si suponemos que la capacidad calorífica molar es independiente de la temperatura, podemos integrar esta ecuación para hallar el incremento entre dos estados
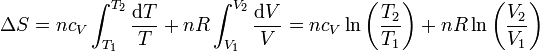
2.2 Expresión en función de T y p
Si lo que tenemos es el cambio en la presión, en lugar del volumen, podemos hacer un cálculo análogo empleando la entalpía
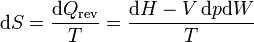
La entalpía se relaciona con la temperatura a través de la capacidad calorífica a presión constante
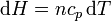
lo que lleva a la expresión para el incremento de entropía
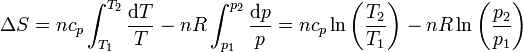
También se puede llegar a este resultado sustituyendo la ecuación de los gases ideales en la expresión en función de T y V.
2.3 Expansión adiabática
Si tenemos un conjunto de moles de un gas que se expande de un volumen V a un volumen 2V, siendo la temperatura final la misma que la inicial, la variación en la entropía del gas es
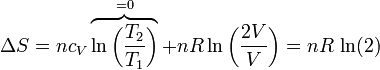
Si usamos como variables la temperatura y la presión (que tienen la ventaja de ser ambas variables intensivas), lo que vemos es que la presión se reduce a la mitad
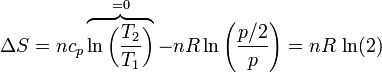
que naturalmente coincide con el resultado anterior.
3 Entropía de una mezcla
La entropía es una propiedad extensiva. Para una sustancia pura esto quiere decir que es proporcional a la cantidad de sustancia, esto es, es proporcional a la masa. Para una mezcla de gases ideales, se comportará como lo hace la masa de la mezcla.
Si tenemos N sustancias, con ni moles de cada una, con una masa molar mi, la masa total será
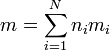
así que la entropía de la mezcla será
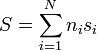
siendo si la entropía por mol de la sustancia i. Una forma análoga tendremos para el incremento de la entropía.
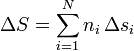
El incremento de la entropía molar para cada sustancia será
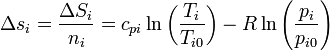
donde las pi son las presiones parciales de los gases de la mezcla, es decir,
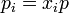
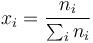
con lo que el incremento de la entropía total es
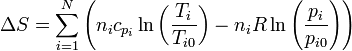
4 Incremento de entropía
En nuestro caso, la temperatura inicial es la misma que la final para los dos gases.


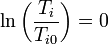
Lo mismo ocurre con la presión total (no con la parcial), ya que inicialmente ambos se encontraban a la misma y al romper la membrana se redistribuyen las moléculas, pero el número de moles total y el volumen total sigue siendo el mismo.
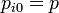
Las presiones parciales sí se ven reducidas pues cada gas pasa a ocupar el volumen total, con el mismo número de moles. las presiones parciales serán
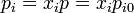
Todo esto deja el aumento de entropía en
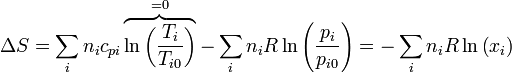
Aplicando la ley de los gases ideales
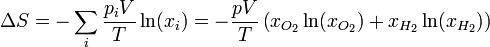
En nuestro caso, las fracciones molares de los dos gases son la misma: un 50%, ya que a igualdad de presión, volumen y temperaturas iniciales les corresponde el mismo número de moles (nótese que no necesitamos calcular cuántos son estos moles).
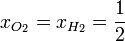
 No se pudo entender (Falta el ejecutable de <strong>texvc</strong>. Por favor, lea <em>math/README</em> para configurarlo.): \Delta S = -\frac{1\,\mathrm{atm}\cdot 2\,\mathrm{l}}{298\,\mathrm{K}}(2\times(0.5\ln(0.5))\cdot\frac{101.325\,\mathrm{J}{1\,\mathrm{atm}\cdot\mathrm{l}} = 0.471\,\frac{\mathrm{J}}{\mathrm{K}}
No se pudo entender (Falta el ejecutable de <strong>texvc</strong>. Por favor, lea <em>math/README</em> para configurarlo.): \Delta S = -\frac{1\,\mathrm{atm}\cdot 2\,\mathrm{l}}{298\,\mathrm{K}}(2\times(0.5\ln(0.5))\cdot\frac{101.325\,\mathrm{J}{1\,\mathrm{atm}\cdot\mathrm{l}} = 0.471\,\frac{\mathrm{J}}{\mathrm{K}}
Vemos que la entropía aumenta, por lo que este proceso es irreversible.





