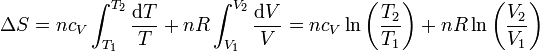Entropía de una mezcla de gases
De Laplace
(Diferencias entre revisiones)
(→Entropía de un gas ideal) |
(→Entropía de un gas ideal) |
||
| Línea 13: | Línea 13: | ||
Para un gas ideal sabemos que | Para un gas ideal sabemos que | ||
| - | <center><math>\mathrm{d}U = nc_V\,\mathrm{d}T{{qquad}}{{qquad}}\mathrm{d}W=-p\,\mathrm{d}V</math>{{tose}}<math>\mathrm{d}S=nc_V\frac{\mathrm{d}T}{T}+\frac{p}{T}\mathrm{d}V</math></center> | + | <center><math>\mathrm{d}U = nc_V\,\mathrm{d}T</math>{{qquad}}{{qquad}}<math>\mathrm{d}W=-p\,\mathrm{d}V</math>{{tose}}<math>\mathrm{d}S=nc_V\frac{\mathrm{d}T}{T}+\frac{p}{T}\mathrm{d}V</math></center> |
Sustituyendo la ecuación de estado del gas ideal | Sustituyendo la ecuación de estado del gas ideal | ||
| Línea 19: | Línea 19: | ||
<center><math>\mathrm{d}S = nc_V\frac{\mathrm{d}T}{T}+nR\,\frac{\mathrm{d}V}{V}</math></center> | <center><math>\mathrm{d}S = nc_V\frac{\mathrm{d}T}{T}+nR\,\frac{\mathrm{d}V}{V}</math></center> | ||
| - | Si suponemos que la capacidad calorífica molar es independiente de la temperatura, podemos integrar esta ecuación para hallar el | + | Si suponemos que la capacidad calorífica molar es independiente de la temperatura, podemos integrar esta ecuación para hallar el incremento entre dos estados |
| + | |||
| + | <center><math>\Delta S = nc_V\int_{T_1}^{T_2}\frac{\mathrm{d}T}{T}+nR\int_{V_1}^{V_2}\frac{\mathrm{d}V}{V}= nc_V\ln\left(\frac{T_2}{T_1}\right)+nR\ln\left(\frac{V_2}{V_1}\right)</math></center> | ||
==Entropía de una mezcla== | ==Entropía de una mezcla== | ||
Revisión de 19:18 28 abr 2009
Contenido |
1 Enunciado
Un recipiente de 2.00 l tiene una barrera que lo divide por la mitad. Una mitad contiene H2 y la otra O2. Ambos gases se encuentran a temperatura ambiente y presión atmosférica. Se retira la barrera de separación, permitiendo que los gases se mezclen. ¿Cuál el aumento de entropía del sistema?
2 Entropía de un gas ideal
Para un gas ideal puro, podemos calcular el incremento diferencial de entropía a partir de la definición
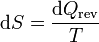
A su vez, el diferencial de calor reversible puede hallarse mediante el primer principio de la termodinámica
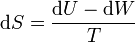
Para un gas ideal sabemos que
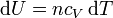
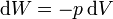

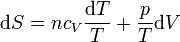
Sustituyendo la ecuación de estado del gas ideal
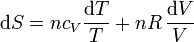
Si suponemos que la capacidad calorífica molar es independiente de la temperatura, podemos integrar esta ecuación para hallar el incremento entre dos estados