Entropía de una mezcla de gases
De Laplace
(Diferencias entre revisiones)
(→Entropía después de la mezcla) |
(→Entropía de un gas ideal) |
||
| Línea 3: | Línea 3: | ||
==Entropía de un gas ideal== | ==Entropía de un gas ideal== | ||
| + | Para un gas ideal puro, podemos calcular el incremento diferencial de entropía a partir de la definición | ||
| + | |||
| + | <center><math>\mathrm{d}S=\frac{\mathrm{d}Q_\mathrm{rev}}{T}</math></center> | ||
| + | |||
| + | A su vez, el diferencial de calor reversible puede hallarse mediante el primer principio de la termodinámica | ||
==Entropía de una mezcla== | ==Entropía de una mezcla== | ||
Revisión de 18:39 28 abr 2009
Contenido |
1 Enunciado
Un recipiente de 2.00 l tiene una barrera que lo divide por la mitad. Una mitad contiene H2 y la otra O2. Ambos gases se encuentran a temperatura ambiente y presión atmosférica. Se retira la barrera de separación, permitiendo que los gases se mezclen. ¿Cuál el aumento de entropía del sistema?
2 Entropía de un gas ideal
Para un gas ideal puro, podemos calcular el incremento diferencial de entropía a partir de la definición
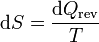
A su vez, el diferencial de calor reversible puede hallarse mediante el primer principio de la termodinámica





