Trabajo máximo en sistema de dos líquidos
De Laplace
| Línea 39: | Línea 39: | ||
<center><math>\mathrm{d}S=\frac{\delta Q^\mathrm{rev}}{T}=\frac{mc\,\mathrm{d}T}{T}\qquad\Rightarrow\qquad \Delta S = mc(\ln(T_f)-\ln(T_i))=mc\ln\left(\frac{T_f}{T_i}\right)</math></center> | <center><math>\mathrm{d}S=\frac{\delta Q^\mathrm{rev}}{T}=\frac{mc\,\mathrm{d}T}{T}\qquad\Rightarrow\qquad \Delta S = mc(\ln(T_f)-\ln(T_i))=mc\ln\left(\frac{T_f}{T_i}\right)</math></center> | ||
| + | |||
| + | y por tanto, la variación de entropía total es | ||
| + | |||
| + | <center><math>\Delta S = m_1 c_1\ln\left(\frac{T_f}{T_1}\right)+m_2 c_2\ln\left(\frac{T_f}{T_2}\right)</math></center> | ||
| + | |||
| + | donde la temperatura debe ser la aabsoluta. Esto nos da el valor | ||
| + | |||
| + | <center><math>\Delta S = \left(4.18\ln\left(\frac{331.5}{300}\right)+4.18\ln\left(\frac{331.5}{363}\right)\right)\frac{\mathrm{kJ}}{\mathrm{K}}=\left(+0.417-0.379\right)\frac{\mathrm{kJ}}{\mathrm{K}}=+37.9\,\frac{\mathrm{J}}{\mathrm{K}}</math></center> | ||
| + | |||
| + | La variación de entropía es positiva, como corresponde a un proceso real irreversible. | ||
==Contacto a través de una pared== | ==Contacto a través de una pared== | ||
[[Categoría:Problemas del segundo principio de la termodinámica (GIE)]] | [[Categoría:Problemas del segundo principio de la termodinámica (GIE)]] | ||
Revisión de 20:08 24 may 2016
Contenido |
1 Enunciado
Se tienen dos recipientes adiabáticos conteniendo 1.0 kg de agua cada uno, a 27°C y 90°C respectivamente. Se ponen en contacto a través de una pared diaterma. Halle:
- La temperatura final del agua.
- La cantidad de calor transferida.
- La variación de entropía en el proceso.
Suponga ahora que el contacto térmico no se hace directamente sino a través de una máquina térmica reversible que usa los recipientes como foco caliente y foco frío. Teniendo en cuenta que todos los procesos son reversibles
- Halle la temperatura final del agua
- Calcule el calor cedido por el agua caliente y el absorbido por el agua fría
- Determine el trabajo que se puede extraer del sistema.
2 Contacto directo
La primera parte del problema es idéntica a la de otro problema de mezcla de dos cantidades de agua.
2.1 Temperatura final
Al ser un recipiente adiabático, no entra calor del exterior, por lo que todo lo que sale del recipiente 2 (el de 90%deg;C) entra en el 1 (el de 27°C)
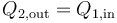
La transferencia de calor se detiene cuando las temperaturas se igualan, por lo que queda
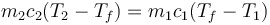
y despejando
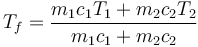
En este caso tanto las masas como los calores específicos son iguales, por lo que resulta una temperatura final que es la media aritmética de las dos iniciales

2.2 Calor transferido
Una vez que tenemos la temperatura final, hallamos la cantidad de calor que pasa de una cámara a la otra.
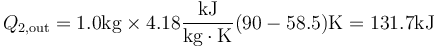
2.3 Producción de entropía
Para hallar la variación de entropía no basta con dividir el calor por la temperatura, sino que hay que suponer un proceso cuasiestático. En ese caso, resulta, para cada sistema
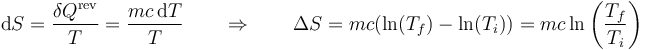
y por tanto, la variación de entropía total es
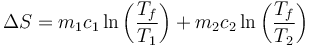
donde la temperatura debe ser la aabsoluta. Esto nos da el valor
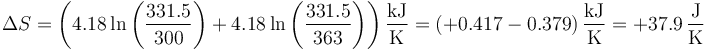
La variación de entropía es positiva, como corresponde a un proceso real irreversible.





