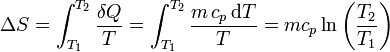Calor necesario para evaporar hielo
De Laplace
| Línea 4: | Línea 4: | ||
Halle el aumento de entropía en cada paso y el total del proceso. | Halle el aumento de entropía en cada paso y el total del proceso. | ||
| - | == | + | ==Calor necesario== |
El proceso completo se compone de cinco partes: tres aumentos de temperatura y dos cambios de fase. Cada aumento de temperatura sigue la fórmula | El proceso completo se compone de cinco partes: tres aumentos de temperatura y dos cambios de fase. Cada aumento de temperatura sigue la fórmula | ||
| Línea 83: | Línea 83: | ||
==Aumento de entropía== | ==Aumento de entropía== | ||
| + | Como en el cálculo del calor, para la entropía tenemos también cinco pasos. | ||
| + | |||
| + | En cada cambio de fase, por tratarse de un proceso isotermo | ||
| + | |||
| + | <center><math>\Delta S = \frac{m\,\Delta h}{T}</math></center> | ||
| + | |||
| + | En cada calentamiento a presión constante | ||
| + | |||
| + | <center><math>\Delta S = \int_{T_1}^{T_2}\frac{\delta Q}{T} = \int_{T_1}^{T_2}\frac{m\,c_p\,\mathrm{d}T}{T}=mc_p\ln\left(\frac{T_2}{T_1}\right)</math></center> | ||
[[Categoría:Problemas del primer principio de la termodinámica (GIE)]] | [[Categoría:Problemas del primer principio de la termodinámica (GIE)]] | ||
[[Categoría:Problemas del segundo principio de la termodinámica (GIE)]] | [[Categoría:Problemas del segundo principio de la termodinámica (GIE)]] | ||
Revisión de 15:17 23 mar 2012
1 Enunciado
Calcule la cantidad de calor necesaria para llevar un bloque de hielo de 500 g inicialmente a −10 °C hasta el estado de vapor de agua a 115 °C, manteniéndose la presión constante en 101.3 kPa.
Halle el aumento de entropía en cada paso y el total del proceso.
2 Calor necesario
El proceso completo se compone de cinco partes: tres aumentos de temperatura y dos cambios de fase. Cada aumento de temperatura sigue la fórmula

donde c es el calor específico (a presión constante), que se supone con un valor constante para todo el rango de temperaturas (aunque diferente en cada fase). Un cálculo muy preciso debería tener en cuenta la variación del calor específico con la temperatura, resultando el calor
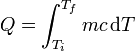
Aquí nos quedaremos en la aproximación de que son constantes, con los valores respectivos para el hielo, el agua y el vapor
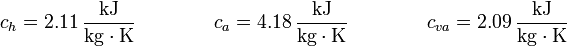
En los cambios de fase la temperatura permanece constante y el calor se emplea en pasar el hielo a agua, o el agua a vapor. La cantidad de calor en cada caso es proporcional a la masa
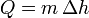
donde la entalpía específica de fusión y la de ebullición tienen los valores

Aplicando estas fórmulas, obtenemos los siguientes valores:
- Hielo hasta el punto de fusión
- Se trata de un aumento de temperatura de 10°C, hasta los 0°C
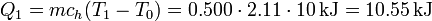
- Fusión del hielo
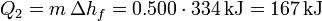
- Calentamiento del agua hasta el punto de ebullición
- es una subida de la temperatura en 100°C
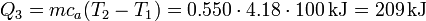
- Ebullición del agua

- Calentamiento del vapor hasta la temperatura final
- El vapor debe calentarse 15°C hasta el estado final
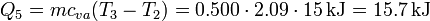
Sumando todos los valores obtenemos el siguiente calor total
| Paso | Q (kJ) | Fracción del calor total (%) |
|---|---|---|
| Hielo a 0°C | 10.6 | 0.7 |
| Fusión | 167 | 10.9% |
| Agua a 100°C | 209 | 13.7% |
| Ebullición | 1128.5 | 73.7% |
| Vapor a 115°C | 15.7 | 1.0% |
| Total | 1530.7 | 100 |
Vemos que, con diferencia, el proceso que requiere más calor es la conversión del agua en vapor de agua.
3 Aumento de entropía
Como en el cálculo del calor, para la entropía tenemos también cinco pasos.
En cada cambio de fase, por tratarse de un proceso isotermo
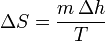
En cada calentamiento a presión constante