Compresión adiabática irreversible
De Laplace
(Página creada con '==Enunciado== Se tiene un cilindro de paredes adiabáticas cerrado por un pistón móvil, también adiabático. En el interior del cilindro se encuentra un gas ideal sitiado ini…') |
(→Caso numérico) |
||
| (18 ediciones intermedias no se muestran.) | |||
| Línea 1: | Línea 1: | ||
==Enunciado== | ==Enunciado== | ||
| - | Se tiene un cilindro de paredes adiabáticas cerrado por un pistón móvil, también adiabático. En el interior del cilindro se encuentra un gas ideal sitiado inicialmente a una presión <math>p_0</math>, una temperatura <math>T_0</math> y ocupando un volumen <math>V_0</math>. De pronto se aumenta bruscamente la presión externa colocando una pesa sobre el pistón, de forma que la nueva presión externa pasa a ser <math>p_1>p_0</math>. El gas se comprime hasta que las presiones interna y externa vuelven a coincidir. | + | Se tiene un cilindro de paredes adiabáticas cerrado por un pistón móvil, también adiabático. En el interior del cilindro se encuentra un gas ideal sitiado inicialmente a una presión <math>p_0</math>, una temperatura <math>T_0</math> y ocupando un volumen <math>V_0</math>. De pronto se aumenta bruscamente la presión externa colocando una pesa sobre el pistón, de forma que la nueva presión externa pasa a ser <math>p_1=rp_0 >p_0</math>. El gas se comprime hasta que las presiones interna y externa vuelven a coincidir. |
# Halle la temperatura final y el volumen final ocupado por el gas. | # Halle la temperatura final y el volumen final ocupado por el gas. | ||
# Calcule el incremento de entropía del sistema | # Calcule el incremento de entropía del sistema | ||
| + | # Supongamos que se trata de un gas diatómico a una presión inicial de 1 atm, una temperatura inicial 20°C y un volumen inicial de 100 cm³. Si la presión final es de 2 atm. ¿Cuál es el volumen y la temperatura finales, el trabajo realizado sobre el sistema y el aumento de entropía? Compárense estos resultados con lo que se obtienen en una compresión adiabática reversible desde 1 a 2 atm. | ||
==Temperatura y volumen final== | ==Temperatura y volumen final== | ||
| + | Al no tratarse de un proceso reversible, aunque se trata de un proceso adiabático no podemos usar la ecuación de Poisson <math>pV^\gamma=\mathrm{cte}</math>, sino que debemos ir a los conceptos básicos. | ||
| + | |||
| + | Tenemos que el proceso es adiabático, por lo que en él | ||
| + | |||
| + | <center><math>Q=0\,</math></center> | ||
| + | |||
| + | De acuerdo con el primer principio de la termodinámica, todo el trabajo realizado sobre el sistema se emplea en aumentar la energía interna | ||
| + | |||
| + | <center><math>W = \Delta U\,</math></center> | ||
| + | |||
| + | El trabajo lo podemos calcular sabiendo que la presión externa es constante en todo el proceso | ||
| + | |||
| + | <center><math>W = -\int_{V_0}^{V_1}p_1\,\mathrm{d}V = -p_1(V_1-V_0)</math></center> | ||
| + | |||
| + | El aumento de la energía interna lo podemos relacionar con el incremento de temperatura. Para un gas ideal | ||
| + | |||
| + | <center><math>\Delta U = nc_v(T_1-T_0) = \frac{c_v}{R}\left(nRT_1-nRT_0\right)=\frac{1}{\gamma-1}\left(p_1V_1-p_0V_0\right)</math></center> | ||
| + | |||
| + | Igualando el trabajo al aumento de la energía interna | ||
| + | |||
| + | <center><math>-p_1(V_1-V_0) = \frac{p_1V_1-p_0V_0}{\gamma-1}</math>{{tose}}<math>V_1 = \left(\frac{(\gamma-1)p_1+p_0}{p_1\gamma}\right)V_0=\left(\frac{(\gamma-1)r+1}{\gamma r}\right)V_0</math></center> | ||
| + | |||
| + | con <math>r = p_1/p_0</math>. | ||
| + | |||
| + | Una vez que tenemos el volumen final tenemos la temperatura | ||
| + | |||
| + | <center><math>T_1 = \frac{p_1V_1}{p_0V_0}T_0 = \left(\frac{(\gamma-1)r+1}{\gamma}\right)T_0</math></center> | ||
| + | |||
==Aumento de entropía== | ==Aumento de entropía== | ||
| + | El aumento de entropía lo calculamos a partir del conocimiento de la entropía de un gas ideal como función de la temperatura y la presión | ||
| + | |||
| + | <center><math>\Delta S = n c_p \ln\left(\frac{T_1}{T_0}\right)- nR \ln\left(\frac{p_1}{p_0}\right)= nc_p\ln\left(\frac{(1-\gamma)r+1}{\gamma}\right)-n R\ln(r) = \frac{p_0V_0}{T_0}\left(\frac{\gamma}{\gamma-1}\ln\left(\frac{(1-\gamma)r+1}{\gamma}\right)-\ln(r)\right)</math></center> | ||
| + | |||
| + | ==Caso numérico== | ||
| + | Tenemos que | ||
| + | |||
| + | <center><math>p_0 = 101325\,\mathrm{Pa}</math>{{qquad}}{{qquad}}<math>T_0=293\,\mathrm{K}</math>{{qquad}}{{qquad}}<math>V_0=10^{-4}\,\mathrm{m}^3</math>{{qquad}}{{qquad}}<math>p_1=2p_0\,</math>{{qquad}}{{qquad}}<math>\gamma = \frac{7}{5}</math></center> | ||
| + | |||
| + | Sustituyendo obtenemos | ||
| + | |||
| + | ;Volumen: El volumen final es | ||
| + | |||
| + | <center><math>V_1 = \frac{9}{14}V_0 = 64.3\,\mathrm{cm}^3</math></center> | ||
| + | |||
| + | :En un proceso adiabático reversible, este volumen sería | ||
| + | |||
| + | <center><math>V'_1 = \left(\frac{p_0}{p_1}\right)^{1/\gamma}V_0 = 60.9\,\mathrm{cm}^3</math></center> | ||
| + | |||
| + | :esto es, la compresión es menor en el proceso adiabático irreversible. | ||
| + | |||
| + | ;Temperatura: Sustituyendo igualmente obtenemos la temperatura final | ||
| + | |||
| + | <center><math>T_1 = \frac{9}{7}T_0 = 376\,\mathrm{K}</math></center> | ||
| + | |||
| + | :En un proceso adiabático reversible, la temperatura final sería | ||
| + | |||
| + | <center><math>T'_1 = \left(\frac{p_0}{p_1}\right)^{(\gamma-1)/\gamma}T_0 = 357\,\mathrm{K}</math></center> | ||
| + | |||
| + | :La temperatura aumenta más en el proceso irreversible que en el reversible. | ||
| + | |||
| + | ;Trabajo y aumento de energía: En el proceso irreversible, el trabajo realizado sobre el sistema es | ||
| + | |||
| + | <center><math>W = \Delta U = -p_1(V_1-V_0)=\frac{p_0V_0(r-1)}{\gamma}=7.24\,\mathrm{J}</math></center> | ||
| + | |||
| + | :En un proceso reversible sería | ||
| + | |||
| + | <center><math>W' = \Delta U' = \frac{p_1V'_1-p_0V_0}{\gamma - 1} = 5.54\,\mathrm{J}</math></center> | ||
| + | |||
| + | ;Entropía: La variación de entropía en el proceso reversible es | ||
| + | |||
| + | <center><math>\Delta S = 6.44\,\frac{\mathrm{mJ}}{\mathrm{K}}</math></center> | ||
| + | |||
| + | :En el proceso reversible alternativo, la variación de entropía es naturalmente nula. | ||
| + | |||
| + | [[Categoría: Problemas del segundo principio de la termodinámica]] | ||
última version al 21:15 27 may 2010
Contenido[ocultar] |
1 Enunciado
Se tiene un cilindro de paredes adiabáticas cerrado por un pistón móvil, también adiabático. En el interior del cilindro se encuentra un gas ideal sitiado inicialmente a una presión p0, una temperatura T0 y ocupando un volumen V0. De pronto se aumenta bruscamente la presión externa colocando una pesa sobre el pistón, de forma que la nueva presión externa pasa a ser p1 = rp0 > p0. El gas se comprime hasta que las presiones interna y externa vuelven a coincidir.
- Halle la temperatura final y el volumen final ocupado por el gas.
- Calcule el incremento de entropía del sistema
- Supongamos que se trata de un gas diatómico a una presión inicial de 1 atm, una temperatura inicial 20°C y un volumen inicial de 100 cm³. Si la presión final es de 2 atm. ¿Cuál es el volumen y la temperatura finales, el trabajo realizado sobre el sistema y el aumento de entropía? Compárense estos resultados con lo que se obtienen en una compresión adiabática reversible desde 1 a 2 atm.
2 Temperatura y volumen final
Al no tratarse de un proceso reversible, aunque se trata de un proceso adiabático no podemos usar la ecuación de Poisson pVγ = cte, sino que debemos ir a los conceptos básicos.
Tenemos que el proceso es adiabático, por lo que en él
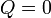
De acuerdo con el primer principio de la termodinámica, todo el trabajo realizado sobre el sistema se emplea en aumentar la energía interna
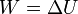
El trabajo lo podemos calcular sabiendo que la presión externa es constante en todo el proceso
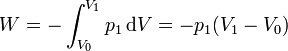
El aumento de la energía interna lo podemos relacionar con el incremento de temperatura. Para un gas ideal
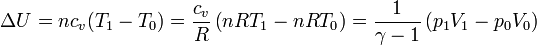
Igualando el trabajo al aumento de la energía interna
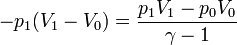

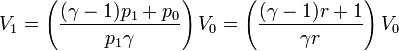
con r = p1 / p0.
Una vez que tenemos el volumen final tenemos la temperatura
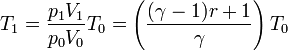
3 Aumento de entropía
El aumento de entropía lo calculamos a partir del conocimiento de la entropía de un gas ideal como función de la temperatura y la presión
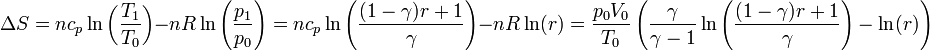
4 Caso numérico
Tenemos que
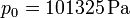
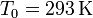
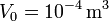
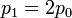
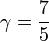
Sustituyendo obtenemos
- Volumen
- El volumen final es
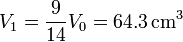
- En un proceso adiabático reversible, este volumen sería
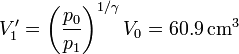
- esto es, la compresión es menor en el proceso adiabático irreversible.
- Temperatura
- Sustituyendo igualmente obtenemos la temperatura final
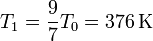
- En un proceso adiabático reversible, la temperatura final sería
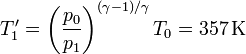
- La temperatura aumenta más en el proceso irreversible que en el reversible.
- Trabajo y aumento de energía
- En el proceso irreversible, el trabajo realizado sobre el sistema es
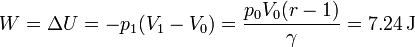
- En un proceso reversible sería
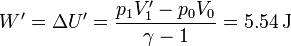
- Entropía
- La variación de entropía en el proceso reversible es
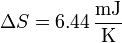
- En el proceso reversible alternativo, la variación de entropía es naturalmente nula.





