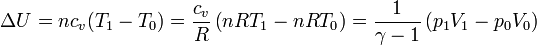Compresión adiabática irreversible
De Laplace
(Página creada con '==Enunciado== Se tiene un cilindro de paredes adiabáticas cerrado por un pistón móvil, también adiabático. En el interior del cilindro se encuentra un gas ideal sitiado ini…') |
(→Temperatura y volumen final) |
||
| Línea 6: | Línea 6: | ||
==Temperatura y volumen final== | ==Temperatura y volumen final== | ||
| + | Al no tratarse de un proceso reversible, aunque se trata de un proceso adiabático no podemos usar la ecuación de Poisson <math>pV^\gamma=\mathrm{cte}</math>, sino que debemos ir a los conceptos básicos. | ||
| + | |||
| + | Tenemos que el proceso es adiabático, por lo que en él | ||
| + | |||
| + | <center><math>Q=0\,</math></center> | ||
| + | |||
| + | De acuerdo con el primer principio de la termodinámica, todo el trabajo realizado sobre el sistema se emplea en aumentar la energía interna | ||
| + | |||
| + | <center><math>W = \Delta U\,</math></center> | ||
| + | |||
| + | El trabajo lo podemos calcular sabiendo que la presión externa es constante en todo el proceso | ||
| + | |||
| + | <center><math>W = -\int_{V_0}^{V_1}p_1\,\mathrm{d}V = -p_1(V_1-V_0)</math></center> | ||
| + | |||
| + | El aumento de la energía interna lo podemos relacionar con el incremento de temperatura. Para un gas ideal | ||
| + | |||
| + | <center><math>\Delta U = nc_v(T_1-T_0) = \frac{c_v}{R}\left(nRT_1-nRT_0\right)=\frac{1}{\gamma-1}\left(p_1V_1-p_0V_0\right)</math></center> | ||
| + | |||
==Aumento de entropía== | ==Aumento de entropía== | ||
Revisión de 17:19 27 may 2010
1 Enunciado
Se tiene un cilindro de paredes adiabáticas cerrado por un pistón móvil, también adiabático. En el interior del cilindro se encuentra un gas ideal sitiado inicialmente a una presión p0, una temperatura T0 y ocupando un volumen V0. De pronto se aumenta bruscamente la presión externa colocando una pesa sobre el pistón, de forma que la nueva presión externa pasa a ser p1 > p0. El gas se comprime hasta que las presiones interna y externa vuelven a coincidir.
- Halle la temperatura final y el volumen final ocupado por el gas.
- Calcule el incremento de entropía del sistema
2 Temperatura y volumen final
Al no tratarse de un proceso reversible, aunque se trata de un proceso adiabático no podemos usar la ecuación de Poisson pVγ = cte, sino que debemos ir a los conceptos básicos.
Tenemos que el proceso es adiabático, por lo que en él
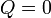
De acuerdo con el primer principio de la termodinámica, todo el trabajo realizado sobre el sistema se emplea en aumentar la energía interna
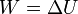
El trabajo lo podemos calcular sabiendo que la presión externa es constante en todo el proceso
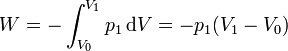
El aumento de la energía interna lo podemos relacionar con el incremento de temperatura. Para un gas ideal