Enunciado de Kelvin-Planck
De Laplace
(→Enunciado) |
(→Equivalencia con el enunciado de Carnot) |
||
| Línea 39: | Línea 39: | ||
==Ejemplos== | ==Ejemplos== | ||
| - | |||
==Relación con el aumento de entropía== | ==Relación con el aumento de entropía== | ||
Revisión de 21:21 19 may 2010
Contenido |
1 Introducción
Cuando se estudian las máquinas térmicas se obtiene que el rendimiento de estas máquinas viene dado por
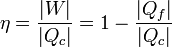
siendo | W | el trabajo neto realizado por la máquina, | Qc | el calor que absorbe del foco caliente para realizar dicho trabajo y | Qf | el calor de desecho que es entregado al foco frío (normalmente el ambiente).
A la hora de aumentar la eficiencia de una máquina, el primer objetivo sería reducir, o eliminar si es posible, ese calor de desecho. Se plantean dos alternativas
- ¿Es posible una máquina térmica que no genere calor de desecho, sino que todo el calor absorbido se transforme en trabajo neto?
- ¿Es posible una reutilización del calor de desecho, de forma que se haga recircular y se incluya en el calor absorbido?
La respuesta a ambas preguntas es negativa.
2 Enunciado
El enunciado de Kelvin-Planck del segundo principio de la termodinámica es el siguiente:
Es imposible construir una máquina que, operando ciclicamente, produzca como único efecto la extracción de calor de un foco y la realización de una cantidad equivalente de trabajo
Este enunciado afirma la imposibilidad de construir una máquina que convierta todo el calor en trabajo. Siempre es necesario intercambiar calor con un segundo foco (el foco frío), de forma que parte del calor absorbido se expulsa como calor de desecho al ambiente.
Matemáticamente, esto implica que el rendimiento de una máquina térmica, que según el Primer Principio de la Termodinámica podría ser igual a la unidad, es en realidad siempre menor que la unidad
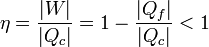
De la equivalencia con el teorema de Carnot se deduce que, de hecho, es un número habitualmente mucho menor que la unidad.
El enunciado de Kelvin-Planck está enunciado de manera negativa: nos dice lo que no es posible, no lo que es posible. Se expone además sin justificación previa: simplemente refleja un hecho empírico, que no ha sido refutado por ninguna experiencia. Es posible, no obstante, justificar el segundo principio de la termodinámica acudiendo a la visión microscópica de los sistemas.
Este enunciado establece una asimetría entre calor y trabajo. Mientras que según el primer principio ambas son formas de variar la energía interna de un sistema, el segundo principio establece una clara diferencia:
- Una máquina puede transformar todo el trabajo en calor (es lo que hace una estufa eléctrica, por ejemplo).
- Una máquina no puede transformar todo el calor en trabajo.
En el enunciado de Kelvin-Planck es importante las palabras “cíclicamente” ya que sí es posible transformar todo el calor en trabajo, siempre que no sea en un proceso cíclico. Por ejemplo, en una expansión isoterma suministramos calor a un gas de forma que éste aumenta su volumen, realizando trabajo. Todo el calor se transforma en trabajo, pero el proceso no es cíclico, ya que el volumen final del sistema es diferente del inicial.





