Primer Principio de la Termodinámica
De Laplace
(→Trabajo) |
(→Calor) |
||
| Línea 22: | Línea 22: | ||
El calor es una función dependiente del camino, esto es, si tenemos un sistema que evoluciona desde un estado A a uno B por dos caminos diferentes, el calor intercambiado en cada uno será diferente, en general. | El calor es una función dependiente del camino, esto es, si tenemos un sistema que evoluciona desde un estado A a uno B por dos caminos diferentes, el calor intercambiado en cada uno será diferente, en general. | ||
| + | |||
| + | Para el calor se toma el criterio de signos siguiente: | ||
| + | |||
| + | * Si el calor va dese el entorno hacia el sistema se considera ''positivo''. | ||
| + | * Si el calor va del sistema hacia el entorno se toma como ''negativo''. | ||
Cuando se estudia la termodinámica al nivel de las partículas que componen un sistema el calor está asociado a la transferencia de energía en grados de libertad microscópicos, esto es, corresponde a un cambio en la energía cinética o potencial de moléculas individuales, de forma que aunque la energía del sistema se incremente (o disminuya) lo hace de forma desorganizada. | Cuando se estudia la termodinámica al nivel de las partículas que componen un sistema el calor está asociado a la transferencia de energía en grados de libertad microscópicos, esto es, corresponde a un cambio en la energía cinética o potencial de moléculas individuales, de forma que aunque la energía del sistema se incremente (o disminuya) lo hace de forma desorganizada. | ||
Revisión de 17:16 9 may 2010
Contenido |
1 Introducción
El principio cero de la termodinámica permite caracterizar los sistemas que se encuentran en equilibrio térmico, a través de la definición de una propiedad común que es la temperatura.
Una vez establecida esta magnitud, se trata de describir las interacciones entre un sistema y su entorno cuando se encuentran a la misma o diferente temperatura. Estas interacciones conllevan la transferencia de energía, que se manifiesta en un cambio en el estado del sistema.
Las propiedades relevantes en el intercambio energático son tres:
- Calor
- Trabajo
- Energía interna
Estas tres magnitudes se relacionan a través del primer principio de la termodinámica.
2 Calor
Definimos el calor, Q, como la transferencia de energía debida a una diferencia de temperaturas.
Si colocamos un sistema en contacto con un entorno a diferente temperatura, apreciamos que se produce un cambio en el sistema hasta que éste alcanza el equilibrio térmico con el entorno, momento en el que deja de evolucionar. En ese proceso intermedio hasta que se llega al equilibrio se ha transferido energía (del entorno hacia el sistema o al revés) en forma de calor.
El calor, por tanto, no es algo que se tiene o se almacena, sino que describe un proceso.
El calor es una función dependiente del camino, esto es, si tenemos un sistema que evoluciona desde un estado A a uno B por dos caminos diferentes, el calor intercambiado en cada uno será diferente, en general.
Para el calor se toma el criterio de signos siguiente:
- Si el calor va dese el entorno hacia el sistema se considera positivo.
- Si el calor va del sistema hacia el entorno se toma como negativo.
Cuando se estudia la termodinámica al nivel de las partículas que componen un sistema el calor está asociado a la transferencia de energía en grados de libertad microscópicos, esto es, corresponde a un cambio en la energía cinética o potencial de moléculas individuales, de forma que aunque la energía del sistema se incremente (o disminuya) lo hace de forma desorganizada.
Por tratarse de una transferencia de energía, el calor se mide en julios (J), si bien otras unidades permanecen en uso, como la caloría, siendo
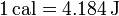
También se usa, especialmente en biología y en referencia a la alimentación, la Caloría (o caloría grande), que es en realidad una kilocaloría
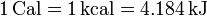
3 Trabajo
El trabajo, en mecánica, se define a través de la integral
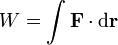
En termodinámica, este concepto se generaliza para incluir las diferentes formas de transferencia de energía que no se deben a una diferencia de temperaturas. Esta generalización permite incluir diferentes tipos de trabajo:





