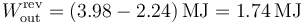Trabajo máximo en sistema de dos gases
De Laplace
Contenido |
1 Enunciado
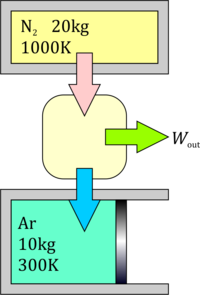
Un tanque de volumen constante contiene 20 kg de nitrógeno a 1000 K y un cilindro a presión constante contiene 10 kg de argón a 300K. Una máquina térmica situada entre el tanque y el cilindro, la cual extrae calor del tanque, realiza un cierto trabajo y expulsa calor al cilindro. Calcule el máximo trabajo que se puede realizar y las temperaturas finales del nitrógeno y el argón en ese caso.
2 Temperatura final
El trabajo máximo se consigue cuando todos los procesos mecánicos o térmicos son reversibles, esto es, cuando no se produce entropía.
La máquina térmica situada entre los dos gases funcionará hasta que se iguale la temperatura de los dos gases sin producción de entropía.
La variación de entropía del foco caliente, teniendo en cuenta que está a volumen constante, será
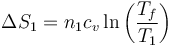
y la del foco frío, que se halla a presión constante
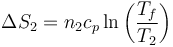
Puesto que la entropía total no cambia en el proceso óptimo
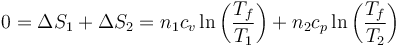
Aplicamos las propiedades de los logaritmos y queda
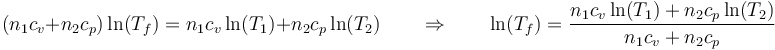
En un proceso normal de mezcla adiabática, la temperatura final habría salido como una expresión similar, pero sin los logaritmos.
En nuestro caso, tenemos los valores de los parámetros siguientes:
- Para el nitrógeno, el número de moles es
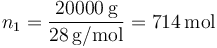
- la capacidad calorífica molar a volumen constante es la de un gas diatómico
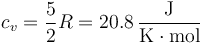
- y la temperatura inicial
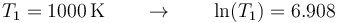
- Para el argón, tenemos el número de moles
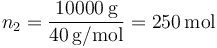
- Las capacidad calorífica molar a presión constante es la de un gas monoatómico

- es decir, en este caso la cv de un gas coincide con la cp del otro. Por último, la temperatura es

Esto nos da, para el logaritmo de la temperatura final
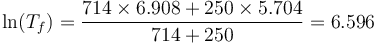
y para la temperatura
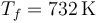
Si simplemente hubiéramos puesto en contacto los dos recipientes, la temperatura final habría sido superior, 819K.
3 Trabajo máximo
El trabajo máximo que podemos obtener es la diferencia entre el calor que extaremos del foco caliente y el que vertemos al foco frío en procesos reversibles
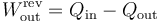
El calor que sacamos del nitrógeno será a volumen constante
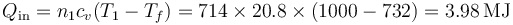
y el que expulsamos al argón

lo que nos da el trabajo máximo