Sistemas termodinámicos (GIE)
De Laplace
Contenido |
1 Objeto de la termodinámica
La termodinámica es la rama de la física que estudia todos los aspectos relacionados con la energía y las magnitudes relacionadas con ella.
El ámbito de aplicación de la termodinámica es prácticamente universal, ya que se puede hablar de energía a todos los niveles. No obstante, el estudio suele limitarse a sistemas macroscópicos. La razón es que las leyes de la termodinámica tienen en su esencia una naturaleza estadística. Describen comportamientos promedio de sistemas de muchas partículas.
Las leyes de la termodinámica son empíricas en el sentido de que describen comportamientos generales de todos los sistemas, aunque que las leyes fundamentales de estos sistemas (gases, líquidos o sólidos) puedan ser muy diferentes.
La termodinámica nació en el contexto de las máquinas térmicas (su nombre significa estudio de la dinámica del calor, entendido éste como el fluido que circula en las máquinas térmicas como la de vapor), aunque posteriormente se extendió a casi cualquier sistema.
2 Sistemas termodinámicos
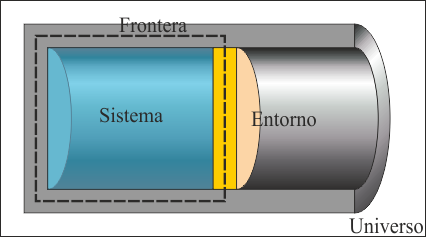
En termodinámica, un sistema es casi cualquier cosa. Se trata de una región del espacio dentro de la cual existen diferentes componentes que interactúan entre sí, intercambiando energía y en ocasiones masa.
Un sistema posee una frontera que lo delimita. Esa frontera puede ser material (las paredes de un recipiente, por ejemplo) o imaginarias (una sección transversal de un tubo de escape abierto, por ejemplo).
La zona del espacio que rodea al sistema y con la cuál éste interactúa mediante intercambios energéticos o materiales se denomina el ambiente o el entorno. El ambiente es la región desde la cual los observadores (que normalmente no forman parte del sistema) hacen las medidas acerca de éste e infieren sus propiedades. A diferencia del sistema, que evoluciona por su interacción con el ambiente, se suele considerar que el ambiente no se ve modificado por esta interacción. Un baño de agua en el que sumerge un cubito de hielo se supone a temperatura constante pese a la fusión del hielo. Si el ambiente estuviera evolucionando como consecuencia de la interacción, lo incluiríamos dentro del sistema y tomaríamos como ambiente una región más externa.
Al conjunto del sistema y el entorno se le denomina el universo. Obsérvese que en termodinámica el universo no es todo el Universo. El cubito de hielo inmerso en una olla con agua es considerado el universo en el estudio de la fusión del hielo.
La frontera de un sistema puede ser:
- Fija (las paredes de un recipiente) o móvil (un émbolo o pistón de un motor de explosión).
- Permeable a la masa o impermeable a ella. En el primer caso se dice que tenemos un sistema abierto (p.ej. un motor en el que entra combustible por un lado y salen gases por otro) y en el segundo uno cerrado (p.ej. en el circuito de refrigeración de una nevera, el gas freón que circula por los tubos nunca sale al exterior).
- Permeable al calor o impermeable a él. Si al poner en contacto el sistema con el ambiente se produce una transferencia de energía debido a la diferencia de temperaturas, se dice que la frontera es diaterma. Si el calor no puede atravesar la frontera se dice que ésta es adiabática
De un sistema cerrado y rodeado por paredes adiabáticas fijas (en el que por tanto no puede entrar ni salir ni masa ni energía), se dice que está aislado.
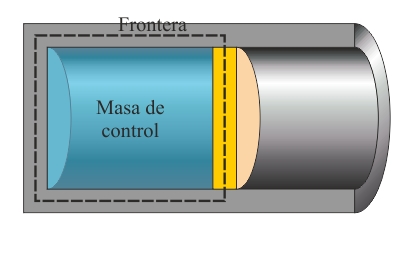
En un sistema cerrado se suele estudiar lo que se denomina una masa de control, cuya evolución se sigue en el tiempo, aunque ocupe una región variable del espacio. El ejemplo arquetípico es el de un cilindro lleno de gas en el que existe un pistón móvil. El pistón puede comprimir o expandir el gas, cuyo volumen por tanto cambia. La masa de gas contenida en el cilindro, en cambio, permanece constante.
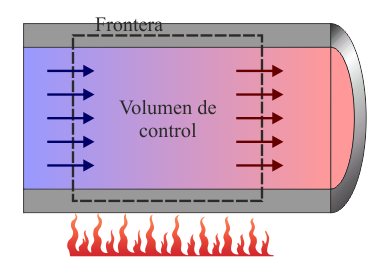
En un sistema abierto se estudia lo que se denomina un volumen de control, usualmente fijo. Se trata de una región del espacio en el interior de la cual está el sistema termodinámico de interés y cuyas paredes pueden ser atravesadas por masa que entra o sale. La frontera del volumen de control podrá tener partes materiales y partes puramente geométricas. Un ejemplo lo tenemos en un calentador de agua doméstico en el cual entra agua fría por un lado del calentador (atravesando una frontera geométrica) fluye por el interior de aparato (con paredes sólidas) y sale, calentada, por el otro extremo (otra frontera inmaterial). En sistemas abiertos son de especial interés los estados de régimen estacionario, en los cuales el fluido entra por un lado y sale por otro lo hace siempre al mismo ritmo, de manera que una “foto” del sistema produce en todo momento la misma “imagen”. Los sistemas en régimen estacionario son más sencillos de estudiar ya que tienen bastantes similitudes con los sistemas cerrados.
En esta introducción a la termodinámica nos centraremos casi exclusivamente en los sistemas cerrados, dejando los sistemas abiertos para cursos más avanzados.
3 Estados de equilibrio
En termodinámica son de especial interés los estados de equilibrio. Un sistema se encuentra en un estado de equilibrio si en ausencia de influencias externas permanece en él indefinidamente.
Existen diferentes tipos de equilibrio. Un sistema puede estar en alguno de ellos pero no en todos, si bien se considera que un sistema está en equilibrio, a secas, si se halla en todos ellos.
- Equilibrio mecánico
- Cuando las distintas partes del sistema no se mueven debido a fuerzas internas. Por ejemplo, si tenemos una bombona de aire cuya presión es mayor en la parte inferior que en la superior, se producirá una corriente de aire de la parte inferior a la superior. En este caso no estaría en equilibrio mecánico.
- Equilibrio térmico
- Cuando el sistema no experimenta flujos de calor internos debido a diferencias de temperatura dentro del sistema. Este concepto quedará explicado más en detalle al establecer el Principio cero de la termodinámica.
- Equilibrio de fases
- Se produce cuando tenemos un sistema formado por la misma sustancia en diferentes estados (por ejemplo, hielo sumergido en agua) y no varía la cantidad de ninguna de las fases.
- Equilibrio químico
- Se da cuando no se producen reacciones químicas en el interior del sistema o, más precisamente, cuando se hallan en equilibrio, de forma que la generación de productos se ve compensada exactamente por la regeneración de reactivos.
- Otros equilibrios
- Cada posible forma de trabajo tiene asociado un equilibrio. Así, por ejemplo, si se ponen en contacto dos cuerpos cargados eléctricamente a diferente voltaje se produce un flujo de carga del de mayor voltaje al de menor voltaje. En el equilibro eléctrico no existe este flujo de carga.
Los estados de equilibrio constituyen una idealización. Ningún sistema físico está completamente en equilibrio (salvo cuando se llegue a la muerte térmica del Universo), pero constituyen modelos adecuados para sistemas que se caracterizan porque sus propiedades permanecen estables durante un tiempo relativamente largo.
4 Estado de un sistema. Variables de estado
Cuando un sistema se encuentra en equilibrio, se puede describir su estado a través de una serie de magnitudes (variables de estado). Estas magnitudes no nos dan una imagen completa de cada aspecto del sistema, sino solo de aquellas propiedades relevantes desde el punto de vista termodinámico.
Así, por ejemplo, para describir un gas contenido en un cilindro podría darse la posición y velocidad de cada una de las moléculas que lo componen, pero esto implica una cantidad excesiva de información, que además es imposible de obtener. Si el gas está en equilibrio, su estado se describe completamente por solo tres variables: su presión (p), su volumen (V) y su temperatura (T). Con estas tres cantidades podemos hallar cualquier otra,como la energía, el trabajo, o la entropía.
Las magnitudes termodinámicas o variables de estado se clasifican en dos tipos:
- Magnitudes intensivas
- Son aquellas que tienen el mismo valor en todos los puntos de un sistema en equilibrio, independientemente del tamaño de éste. Magnitudes intensivas son:
- la presión
- la temperatura
- las magnitudes específicas (definidas más adelante)
- …
- Magnitudes extensivas
- Son proporcionales al tamaño del sistema, de forma que si el sistema se corta por la mitad, sus valores se reducen a la mitad (cosa que no ocurre con las magnitudes intensivas). Son magnitudes extensivas:
- la masa
- el volumen
- el número de moles
- la energía
- la entropía
- …
A partir de las magnitudes extensivas se define una serie de magnitudes intensivas conocidas como:
- Magnitudes específicas
- se obtienen dividiendo la magnitud en cuestión por otra magnitud extensiva. Así tenemos magnitudes espécificas
- por unidad de masa. Así tenemos el volumen específico
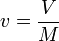
- la energía por unidad de masa, la entropía por unidad de masa, etc.
- por unidad de volumen. El ejemplo más característico es la densidad de masa, igual a la masa por unidad de volumen:
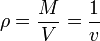
- En un sistema homogéneo en equilibrio, la densidad de masa es la misma en todos los puntos, por lo que no es preciso emplear diferenciales.
- por número de moles. Al tratar con gases, es usual definir también cantidades específicas dividiendo por el número de moles del sistema. Así tenemos el volumen molar (que sería el volumen ocupado por un mol), la capacidad calorífica molar, etc.
Como notación básica, las magnitudes extensivas se suelen representar con letras mayúsculas y las específicas correspondientes con la misma letra en minúsculas, aunque esta regla no es sistemática.
Cuando un estado de equilibrio se puede caracterizar por un número reducido de variables, es posible hacer una representación gráfica del sistema en un “diagrama de estados”, en el que a cada estado de equilibrio le corresponde un punto en el diagrama. Así, por ejemplo, el estado de un sistema cerrado formado solo por un gas se puede conocer dando su presión y su volumen. Esto permite representar el estado del gas en un diagrama PV, en el que en el eje de abscisas se representa el volumen del gas y el de ordenadas su presión.
En un diagrama de estados es posible representar no solo estados individuales, sino también conjuntos de ellos. Así, podemos trazar:
- una isobara, formada por todos los estados con la misma presión, que será una recta horizontal.
- una isocora, que une todos los estados con el mismo volumen, y que será una recta vertical
- una isoterma, que une todos los estados con la misma temperatura. Esta curva dependerá del gas en concreto, ya que la temperatura depende de la presión y el volumen según la llamada ecuación de estado.
En un diagrama de estados pueden representarse también los estados de la materia. Así sabemos que a 20 °C y 1 atm de presión el agua es líquida, pero a la misma presión y a −10 °C es sólida (hielo). Así podemos construir un “mapa” que nos diga, para cada presión y cada temperatura, en qué estado se encuentra la sustancia.
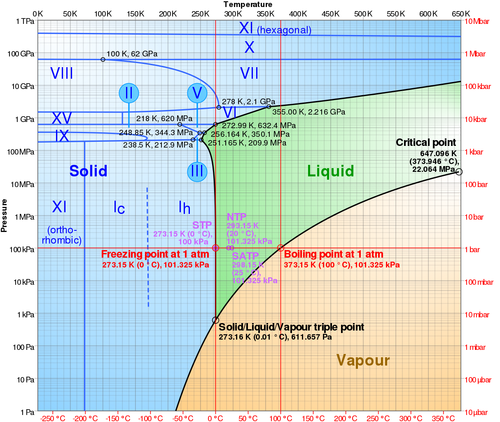
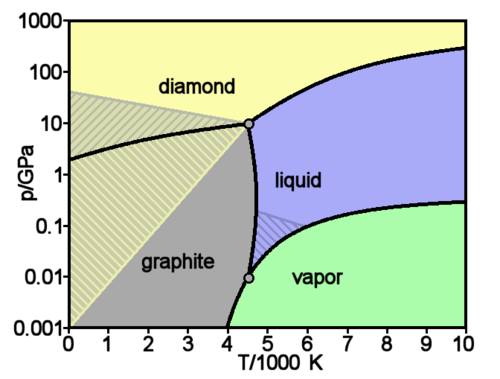
5 Ecuaciones de estado
Al definir el estado de un sistema por una serie de magnitudes termodinámicas, no todas ellas son necesarias o independientes. Así, en un gas contenido en un cilindro, podemos dar su presión y su temperatura, y automáticamente podemos conocer su volumen. La razón es que existe una relación matemática entre las tres variables, conocida como ecuación de estado, expresable como una cierta función
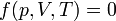
En sistemas más complejos, pueden aparecer más variables en la ecuación de estado o pueden necesitarse más ecuaciones. La ecuación de estado usualmente no tendrá una forma sencilla y de hecho, deberá hallarse a partir de medidas experimentales, con sucesivas correcciones. Solo en contados casos como el de los gases ideales -que, como su nombre indica, son ideales- tendrá una expresión analítica simple como pV = nRT.
En el caso de sistema cerrado conteniendo un gas tenemos entonces dos variables independientes y el resto son dependientes. Cuáles son independientes es decisión nuestra; podemos dar p y V, o p y T, o T y V; lo que no podemos es dar por separado las tres variables.
6 Procesos y ciclos
Aunque la termodinámica básica se centra casi exclusivamente en los estados de equilibrio, es necesario estudiar también la transición de un estado de equilibrio a otro, si no, sería de muy poca utilidad.
El paso de un estado de un estado de equilibrio a otro se denomina un proceso. En general, un proceso no está constituido por estados de equilibrio. Por ejemplo, si tenemos un gas contenido a alta presión en un recipiente, y rompemos un diafragma que lo separa de una cámara vacía, se produce una expansión brusca, en la cual hay toda clase de turbulencias y variaciones en la presión de un punto a otro. Pasado un cierto tiempo, el gas alcanzará un nuevo estado de equilibrio. En un diagrama de estados podremos representar el estado inicial y el estado final, pero no lo que ocurre en medio, ya que ni siquiera están definidas las variables termodinámicas.
Un proceso que evoluciona de forma que el estado del sistema es aproximadamente de equilibrio en todo momento se denomina proceso cuasiestático o de cuasi-equilibrio. Los procesos cuasiestáticos son procesos que se realizan muy lentamente (idealmente en un tiempo infinito) de manera que se deje alcanzar el equilibrio entre paso y paso. Así, podemos comprimir un gas en un cilindro golpeando el pistón con un martillo, o podemos hacerlo dejando caer granos de arena individualmente, hasta que el peso de la arena comprima el pistón hasta su volumen final. En el primer caso el proceso no pasa por estados de equilibrio, mientras que en el segundo se puede suponer que sí.
Los procesos cuasiestáticos no existen en la vida real, sin embargo, son de gran utilidad por dos razones:
- Permiten realizar los cálculos empleando las ecuaciones de estado
- La variación de muchas magnitudes depende solo de los estados inicial y final y no del proceso intermedio. Por tanto, para calcularlas podemos sustituir el proceso real no cuasiestático por uno ideal cuasiestático que conecte los mismos estados inicial y final.
Dentro de un sistema gaseoso, existen diferentes procesos cuasiestáticos que poseen nombre propio, de acuerdo con la magnitud que permanezca constante:
- Isóbaros o a presión constante.
- Isócoros o a volumen constante.
- Isotermos o a temperatura constante
- Adiabáticos. Como veremos al estudiar el primer principio de la termodinámica, son aquellos en que el sistema no intercambia calor con el ambiente. Al estudiar el segundo principio veremos que un proceso adiabático cuasiestático es a entropía constante.
Además de estos existen otros a entalpía constante, a energía constante, etc.
Un proceso cíclico o ciclo es un proceso termodinámico cuyo estado final es el mismo que el inicial. Los ciclos son esenciales a la hora de describir el funcionamiento de motores y generadores, por lo que muchos tienen nombre propio (Carnot, Otto, Diesel, Rankine, Brayton,...). Como con cualquier otro proceso, pueden ser aproximadamente cuasiestáticos, en cuyo caso se representarán en un diagrama de estados como una curva cerrada.