Producción de entropía por descompresión
De Laplace
Contenido |
1 Enunciado
Se tiene un cilindro de 20 cm de diámetro tapado por un émbolo situado inicialmente a 14 cm del fondo. En el interior del émbolo se encuentra aire comprimido a 4.0 bares, siendo la presión exterior 100 kPa. La temperatura exterior y la inicial del aire de la cámara es 294 K. Las paredes del cilindro y el pistón son completamente adiabáticos.
Inicialmente, el pistón está sujeto por un perno, que se libera bruscamente, produciéndose una expansión abrupta.
Calcule la posición final del émbolo, una vez que se alcanza de nuevo el equilibrio, la temperatura final del aire y la variación de entropía en el proceso. Halle la variación en la exergía del gas en el proceso.
2 Temperatura y volumen
Inicialmente tenemos el gas a una presión pA, ocupando un volumen VA y con una temperatura TA = T0 siendo T0 la temperatura exterior. Una vez que se libera el pistón el gas se expande debido a la diferencia de presiones. El estado final se caracteriza porque pB = p0, siendo p0 la presión exterior. El volumen final será VB. La temperatura final TB no tiene por qué coincidir con la inicial, pues al estar el recipiente aislado térmicamente no se alcanza el equilibrio térmico con el exterior.
Numéricamente
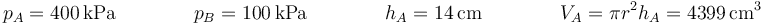
Se cumple la relación

Obtenemos el estado final aplicando el primer principio de la termodinámica.
La presión exterior es en todo momento la atmosférica, por lo que el trabajo realizado sobre el gas vale

Este trabajo será negativo, pues en realidad es el gas el que lo realiza.
Al ser las paredes adiabáticas, no existe transferencia de calor con el exterior y el calor que entra en el sistema es nulo
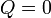
Por tanto, el trabajo realizado sobre el sistema corresponde a una variación de su energía interna
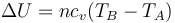
cumpliéndose
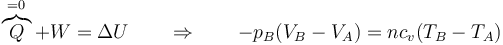
Podemos poner el segundo miembro en términos de la presión y el volumen del gas
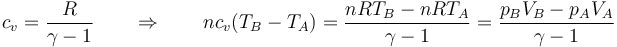
lo que nos da la ecuación para el volumen final
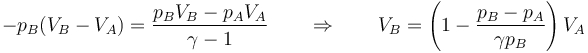
Esta es la misma relación que se obtiene en el problema de la compresión por un peso.
Una vez hallado el volumen, podemos calcular la temperatura final

El valor numérico de la altura final del pistón es

del volumen

y de la temperatura final del aire

Vemos que en la expansión la temperatura desciende bruscamente en 63 grados. Este es un ejemplo de enfriamiento adiabático. Siempre que un gas se expande bruscamente como ocurre en la válvula de expansión de un refrigerador, su temperatura cae, quedando, como en este caso, muy por debajo de la del ambiente.
3 Entropía
Normalmente se asocia el cambio en la entropía a la extracción o cesión de calor. Sin embargo, en este caso, la transferencia de calor es nula, por lo que el cambio de entropía no puede deberse a él.
Alternativamente, puede pensarse que si la temperatura de un sistema disminuye, también debe disminuir su entropía. Si ese fuera el único factor relevante, en este caso tendríamos una reducción de entropía en el universo, lo cual no puede ocurrir, pues una expansión de un tubo de aire comprimido es perfectamente posible.
Para hacer los cálculos correctamente hay que tener en cuenta que la entropía de un gas también depende los cambios en su volumen, de forma que tenemos

o, en función de la temperatura y la presión
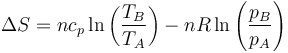
Para los coeficientes tenemos que
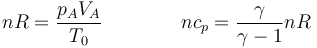
Esto nos da la variación de entropía

Puede uno plantearse cómo es que aumenta la entropía del sistema si no hay intercambio de calor y tampoco varía la entropía del ambiente. ¿Cómo se calcularía la variación de entropía si no se tuviera la fórmula para la entropía de un gas ideal?
La respuesta sería que, en lugar del proceso real, deberíamos considerar un proceso reversible que llevara del estado inicial al final. Este proceso reversible debe ser cuasiestático y conlleva intercambio de calor. Una vez claculado cuánto calor entraría en ese proceso imaginario, hallaríamos la variación de entropía como
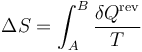
4 Exergía
La exergía de un sistema es una función de estado que nos da el máximo trabajo útil que se puede extraer de él. En el caso de un fluido, tiene la expresión
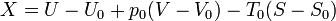
siendo p0 y T0 la presión y temperaturas del entorno y U0, V0 y S0 la energía interna, el volumen y la entropía del sistema cuando alcanza el estado muerto, es decir, cuando llega al equilibrio térmico y mecánico con el ambiente.
Puesto que la presión y temperatura externas son constantes, la variación de exergía entre dos estados es igual a
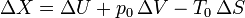
En nuestro caso tenemos
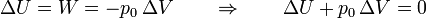
lo que reduce la variación de la exergía a

Puesto que se ha producido entropía en el proceso, se ha desperdiciado trabajo y reducido la exergía.
El valor final de la exergía no es nulo, ya que el gas aun no ha alcanzado el estado muerto. Su presión iguala a la exterior, pero su temperatura es diferente.
Cuando llega al estado muerto tenemos que
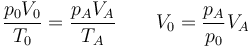
que en este caso significa que el volumen inicial se multiplica por 4.
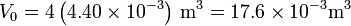
La energía interna inicial y la del estado muerto tienen el mismo valor, por ser igual la temperatura
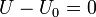
mientras que el cambio de entropía respecto al estado inicial es
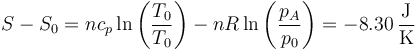
lo que nos da la exergía inicial
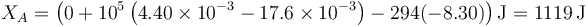
y tras la expansión






