Mezcla de agua y vapor
De Laplace
1 Enunciado
En un calorímetro que contiene 200 g de hielo a -8.00 °C se introducen 50.0 g de vapor de agua a 100 °C. El equivalente en agua del calorímetro es 20.0 g. Determina el estado final de la mezcla.
Datos: calor específico del hielo: 0.500 cal/g °C; entalpía de fusión del hielo: 80.0cal/g; entalpía de vaporización del agua: 537 cal/g
2 Solución
Supongamos que el estado final de la mezcla es agua líquida a una cierta temperatura. El vapor tiene que condensarse en agua líquida y después enfriarse hasta la temperatura final. Por su parte, el hielo tiene que calentarse para llegar a 0°C, luego derretirse y después calentarse hasta la temperatura final de la mezcla. Además hay que tener en cuenta el calor intercambiado por el calorímetro. El proceso que sigue cada uno de los sistemas es
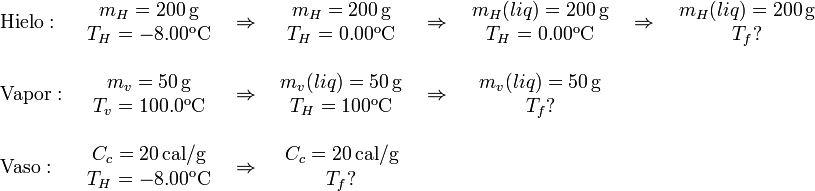
La capacidad calorífica del calorímetro es el productor de su equivalente en agua por el calor específico del agua líquida
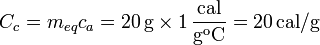
Ahora podemos calcular el calor transferido por cada uno de los sistemas
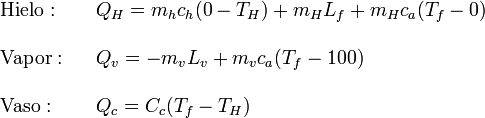
El calor de fusión entra con signo positivo pues el hielo absorbe calor para derretirse, mientras que el calor de vaporización entra con signo negativo pues el vapor cede calor al condensarse. Obsérvese que el calorímetro no se ve afectado por cambios de fase. El dato del equivalente en agua del vaso nos sirve para calcular su capacidad calorífica, pero no significa que cambie de fase como el agua.
Como el sistema está aislado debe cumplirse
QH + Qv + Qc = 0
Esto nos da una ecuación para una incógnita, la temperatura final de la mezcla. Obtenemos
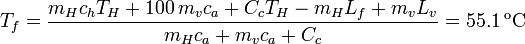
La temperatura final es coherente con la suposición que hemos hecho de que el estado final de la mezcla es agua líquida a una cierta temperatura. Si hubiese salido una temperatura negativa querría decir que en el estado final habría hielo no derretido, mientras que si hubiese salido mayor que 100 °C querría decir que parte del vapor no se condensa. En esos casos habría que modificar los procesos que siguen cada uno de los sistemas.





