Introducción a la exergía
De Laplace
Contenido |
1 Concepto
La exergía es una medida de la disponibilidad de la energía. La idea es que parte de la energía de un sistema se puede aprovechar para realizar trabajo mecánico, eléctrico o de otro tipo. El segundo principio de la termodinámica nos establece limitaciones en cuanto a la cantidad de trabajo que podemos realizar. Pero existe además una limitación práctica en cuanto a que sólo se puede realizar trabajo si el sistema almacena una energía respecto al ambiente que le rodea.
Por ejemplo, consideremos el agua situada en un embalse a cierta altura. Este agua puede emplearse para mover turbinas y generar energía eléctrica, pero, una vez que todo el agua ha bajado al nivel del mar, ya no se puede seguir aprovechando. Hay un límite en la energía disponible asociado a la diferencia de altura entre el agua del embalse y el entorno. Cuando este desnivel desaparece, ya no hay más energía disponible.
Supongamos un recipiente que contiene un gas a alta presión y alta temperatura. Si hacemos un orificio en el recipiente y dejamos que salga el aire a la atmósfera, perdemos toda la energía disponible, ya que rápidamente su presión se iguala a la atmosférica y en poco tiempo su temperatura se iguala la del aire que lo rodea. Hemos desperdiciado toda la energía disponible o exergía.
En cambio, podíamos haber usado el que la presión era superior a la atmosférica para producir un trabajo mecánico, moviendo un pistón, y podíamos haber usado el que su temperatura era superior a la atmosférica para alimentar una máquina térmica, es decir, que tanto la diferencia de presiones como la diferencia de temperaturas eran aprovechables para realizar trabajo útil.
Se denomina “exergía” a la cantidad máxima de energía que puede transformarse en trabajo útil, entendiendo por útil el que no se emplea en actuar contra el ambiente.
La exergía se consume por completo cuando la presión y la temperatura (y el resto de variables de estado como la altura sobre el nivel del mar, el voltaje, etc. que lo diferencian de lo que le rodea) se igualan a la del entorno. Una vez que se iguala la temperatura del sistema con la del ambiente (alcanzándose el equilibrio térmico) y se iguala su presión con la exterior (llegándose al equilibrio mecánico), ya no se puede extraer energía adicional. Se dice que en ese caso el sistema ha alcanzado el “estado muerto”.
2 Caso de un sistema cerrado fluido
El cálculo de la exergía es muy general y puede aplicarse a todo tipo de sistemas físicos. En esta introducción nos limitaremos a considerar el caso sencillo de un sistema fluido (un gas) que se encuentra a una cierta presión p y temperatura T diferentes de la presión p0 y temperatura T0 del aire que lo rodea.
Calcularemos por separado la cantidad máxima de trabajo que podemos obtener por la diferencia de presiones y por la diferencia de temperaturas. La suma de las dos cantidades nos permitirá hallar la exergía del sistema.
2.1 Aprovechamiento de la energía cinética y potencial
Si tenemos un fluido en movimiento respecto al entorno (por ejemplo un río), su energía cinética puede convertirse en trabajo (según el teorema de las fuerzas vivas). Así, un río puede mover una noria o un molino.
Lo mismo ocurre con la energía potencial. Teóricamente puede convertirse íntegramente en trabajo. Un salto de agua puede mover una turbina de una central hidroeléctrica.
Por tanto, la cantidad máxima de trabajo extraíble debe incluir tanto la energía cinética como la potencial, ya que ambas se pueden transformar en trabajo sin pérdida alguna (idealmente).
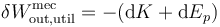
2.2 Aprovechamiento de la presión
Puesto que estamos interesados en el máximo aprovechamiento de la energía, debemos considerar procesos en los que no se produzca entropía en el universo, es decir, deben ser cuasiestáticos y reversibles. En este caso, el trabajo realizado por el sistema vale
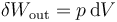
Estamos interesados en los procesos en el que este trabajo resulta positivo, ya que en ese caso es el gas el que realiza trabajo sobre el entorno.
Ahora bien, este trabajo no es todo trabajo útil. Una parte de él se emplea en desplazar el aire exterior, que está a presión p0. Este desplazamiento del ambiente se diluye en la masa y no es aprovechable. Por ello, hacemos la descomposición siguiente
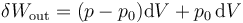
De estos dos términos, sólo el primero es trabajo útil. El segundo representa el trabajo para desplazar el aire de alrededor. Por ejemplo, en un sistema de un gas con un muelle el primer término sería el trabajo para comprimir el muelle (que queda almacenado como energía elástica y puede ser usado más adelante) mientras que el segundo es el trabajo de expansión contra la presión externa, que se pierde.
En un proceso cíclico la integral del segundo término se anula (ya que p0 es constante y ΔV = 0 en un ciclo) lo que quiere decir que si al final estamos como al principio ese trabajo de desplazamiento del aire exterior es recuperado cuando vuelve a ocupar su lugar.
Nos queda entonces la relación
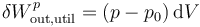
2.3 Aprovechamiento del calor
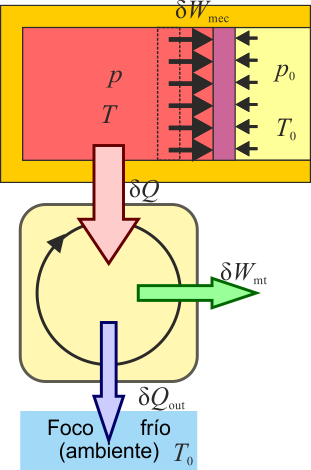
Por estar a una temperatura diferente a la del ambiente, podemos aprovechar esta diferencia para alimentar una máquina térmica que funcione entre la temperatura del sistema y la del ambiente.
El trabajo máximo lo obtendremos con una máquina reversible que opere entre las dos temperaturas. Dado que la temperatura del sistema va cambiando (a medida que se va acercando al equilibrio térmico), esta hipotética máquina es muy especial, ya que funciona con una entrada a temperatura variable. Puesto que se trata de establecer un máximo, podemos admitir esta hipótesis, sabiendo una máquina real no podría hacer tal cosa (habría que sustituirla por una serie de máquinas que actuarían consecutivamente).
En un momento dado, el sistema posee una temperatura absoluta T y cede a la máquina la cantidad de calor que sale del sistema, 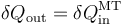 . El trabajo proporcionado por esta máquina sería, por el teorema de Carnot
. El trabajo proporcionado por esta máquina sería, por el teorema de Carnot
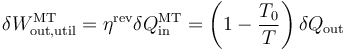
Pero, por tratarse de un proceso reversible, se cumple
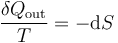
Por tanto, obtenemos para el trabajo producido por la diferencia de temperaturas
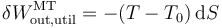
2.4 Exergía
Sumando las tres contribuciones obtenemos el trabajo total útil
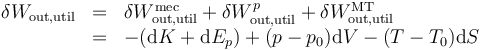
pero, por la primera identidad de Gibbs
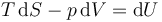
siendo U la energía interna. Sumándole los términos de energía cinética y potencial resulta la energía total.
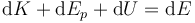
Queda entonces
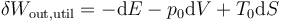
El segundo miembro de esta ecuación es el diferencial de una función de estado, ya que se trata de una combinación de tres diferenciales de funciones de estado multiplicadas por constantes. Por tanto, podemos escribir esto como una diferencial exacta (con “d” en vez de con “δ”). Puesto que al realizar trabajo disminuye la cantidad de trabajo disponible para el futuro, escribimos entonces
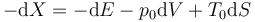
donde X es la función de estado que denominamos exergía.
Integrando entre el estado inicial (que indicamos sin subíndices) y el estado final, que corresponde al estado muerto en el que la temperatura y la presión son iguales a la exterior (con subíndice 0) nos queda
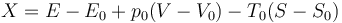
Este es el máximo valor de trabajo que podemos extraer de manera útil de este sistema.
Separando la energía total en sus componentes queda
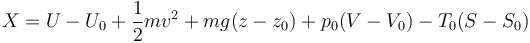
De esta expresión vemos que la exergía es una propiedad extensiva, que se mide en julios en el SI. Vemos que incluye también la posibilidad de realizar trabajo a costa de la energía cinética o potencial del sistema.
Si lo que conocemos es la entalpía
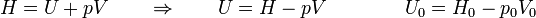
y queda
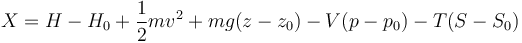
3 Ejemplo
3.1 Gas comprimido a alta temperatura
Consideremos un volumen de 1.0 m³ de aire que está a 400kPa de presión y 600 K de temperatura, siendo la presión exterior de 100 kPa y la temperatura de 300 K, ¿cuánto vale la exergía del aire?
El número de moles de aire vale
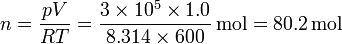
La variación en la energía interna del aire es
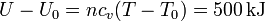
El volumen del aire tras el enfriamiento es
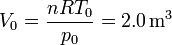
por lo que la segunda contribución a la exergía viene dada por
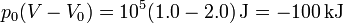
Por último, la variación en la entropía vale
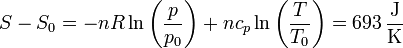
lo que nos da el tercer término
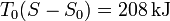
Sustituyendo las tres contribuciones
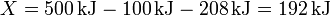
3.2 Gas frío a baja presión
Aunque la fórmula anterior ha sido deducida suponiendo que el fluido se encuentra a un presión y temperatura mayores que las del entorno, también es válida si son inferiores.
Supongamos que tenemos un gas a una presión más baja que la del ambiente. En ese caso, la presión exterior tiende a comprimir el gas, realizando trabajo sobre él. Este trabajo puede ser almacenado de alguna forma (como energía elástica o eléctrica, por ejemplo), por lo que es trabajo útil. Igualmente, si su temperatura del gas es inferior a la del entorno, podría emplearse una máquina térmica que lo empleara como foco frío, realizando trabajo útil.
Por ejemplo, supongamos 1.0 m³ de aire a 50 kPa de presión y 200 K de temperatura, rodeado de un ambiente a 100 kPa y 300 K. El número de moles de gas en este caso
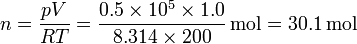
El término de la energía interna vale ahora
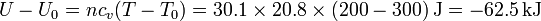
El volumen tras la compresión y el calentamiento es
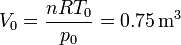
lo que nos da el término
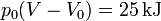
y para la entropía tenemos
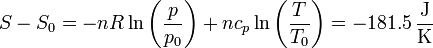
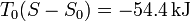
lo que nos da la exergía

que es de nuevo positiva, indicando que del sistema se puede extraer trabajo útil.
4 Exergía y entropía
La exergia nos da el máximo de trabajo útil que podemos extraer de un sistema, apurando al límite las posibilidades que ofrece el segundo principio de la termodinámica. Para ello, hay que suponer procesos completamente reversibles y por tanto sin producción de entropía.
En un proceso real siempre se produce entropía. La producción de entropía implica una reducción del trabajo útil que podemos extraer del sistema, es decir, cuanto mayor en la producción de entropía, menor es el aprovechamiento de su exergía.