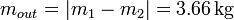Gas que escapa de un tanque a temperatura constante GIA
De Laplace
1 Enunciado
Un manómetro sumergido en un tanque registra la presión nanométrica, que es la diferencia entre la presión interior y exterior (esta última es la presión atmosférica). Cuando el tanque se llena de oxígeno (O2), contiene 10.0 kg de gas a una presión manométrica de 40.0 atm. Determina la masa de oxígeno que se ha extraído del tanque cuando se mide una presión manométrica de 25.0 atm. Supón que la temperatura de tanque permanece constante.
2 Solución
La presión manómetrica es la presión del gas respecto a la presión atmósferica. Así, las presiones absolutas del gas al principio y al final del proceso son
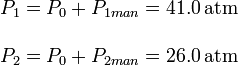
El proceso es a temperatura y volumen constante. En este caso lo que cambia es el número de moles del gas. La ecuación de estado de los gases ideales aplicada en los estados inicial y final es

Dividiendo una por otra obtenemos
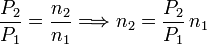
La masa del gas es proporcional al número de moles
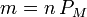
donde PM es el peso molecular. Por tanto la masa en el estado final es
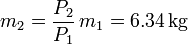
La masa que ha salido es