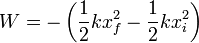Gas ideal y resorte
De Laplace
Contenido |
1 Enunciado
Suponga el siguiente sistema: un cilindro de sección A y altura H se encuentra dividido en dos cámaras por un pistón móvil. En una de ellas hay n moles de un gas ideal diatómico. En la otra hay vacío. El pistón se encuentra unido al extremo del cilindro por un resorte de constante k y longitud natural H.
- Determine la posición x del pistón cuando el gas se encuentra a una temperatura T
- Teniendo en cuenta que el sistema se compone tanto del gas como del resorte, halle la energía interna del sistema.
- Suponga que se comunica una cierta cantidad de calor Q al sistema. ¿Cuál es la nueva posición del pistón? ¿Y la nueva temperatura?
- Si consideramos como sistema sólo el gas, ¿cual es su energía interna tras la absorción de calor? ¿Cuánto trabajo entra en este sistema en el proceso?
2 Posición de equilibrio
El equilibrio se alcanza cuando la fuerza sobre el pistón es nula. La fuerza es la suma de la ejercida por la presión del gas, que empuja hacia arriba, y la del resorte, que empuja hacia abajo proporcionalmente a cuánto se eleva el pistón. La condición de equilibrio es entonces

Llevando esto a la ecuación de los gases ideales
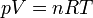

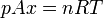

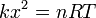
con lo que la posición de equilibrio es
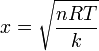
3 Energía interna
La energía interna del sistema es la suma de la que almacena el gas más la que almacena el resorte. La del gas es, teniendo en cuenta que es diatómico
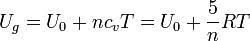
La del resorte es la energía potencial elástica

Sumando las dos
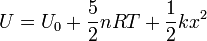
En el equilibrio podemos sustituir la relación del apartado anterior
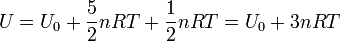
4 Adición de calor
Cuando se introduce calor en el sistema todo el se emplea en aumentar su energía interna, ya que el sistema no realiza trabajo. Aunque el gas al calentarse se expande y comprime el resorte, este trabajo es interno y queda incluido dentro de la energía interna. No se contabiliza como trabajo realizado sobre el sistema.
Por tanto
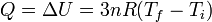
La nueva temperatura es
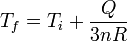
La nueva posición de equilibrio
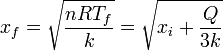
5 Proceso para el gas
Si consideramos que nuestro sistema es solo el gas, entonces el aumento de energía interna es solo
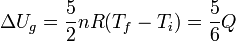
La diferencia entre el calor que entre en el gas y el aumento de la energía interna dos da el trabajo realizado sobre el gas
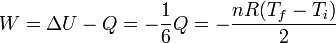
Este trabajo es negativo porque lo realiza el sistema (el gas) sobre el resorte, al comprimirlo, siendo igual a