Aprovechamiento máximo del calor
De Laplace
Contenido |
1 Enunciado
Se desea caldear una habitación a 22°C cuando la temperatura de la calle es de 5°C. Para ello se dispone de un ladrillo de 50 kg de hierro que previamente se ha calentado a 200°C.
Si se coloca el ladrillo directamente en la habitación, ¿cuánto calor se libera? ¿Cuánta entropía se produce?
Supongamos que en lugar de meter el ladrillo se usa como foco caliente de una máquina reversible que alimenta una bomba de calor también reversible. En ese caso, ¿cuánto calor entra en la habitación? ¿Cuánta entropía se produce?
Dato: Calor específico del hierro 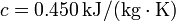
2 Calor liberado directamente
Si calentamos la habitación simplemente depositando el bloque en la habitación, la cantidad de calor que libera es la correspondiente al descenso de temperatura desde su valor inicial, que llamaremos T1 a T0, la temperatura de la habitación (que, por ser de gran tamaño supondremos un baño térmico). Este calor es
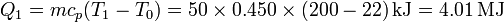
3 Variación de entropía
Existen dos cambios en la entropía, uno en el bloque de hierro, que al enfriarse ve reducida su entropía, y otro en la habitación que al recibir calor la ve incrementada.
3.1 Variación en el ambiente
La habitación recibe calor a una temperatura constante T0, por lo que su aumento de entropía es simplemente
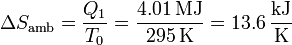
3.2 Variación en el bloque
La variación para el bloque la calculamos suponiendo un proceso reversible, consistente en que su temperatura va bajando gradualmente, siendo uniforme en el bloque en todo momento. En ese caso
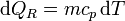

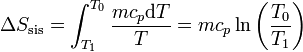
siendo su valor numérico
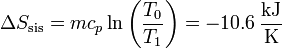
3.3 Variación total
Sumando los dos incrementos
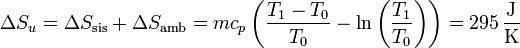
La variación neta es positiva, como corresponde a un proceso posible e irreversible.
4 Trabajo perdido
Parecería que colocar el bloque en la habitación es la forma más eficiente de calentar ésta, ya que todo el calor saliente va a parar a ella. Sin embargo, no lo es. Desde el mismo momento que hay producción de entropía y el proceso es irreversible, es claro que debe haber algún proceso más eficiente que sea reversible.
La causa de la irreversibilidad es la diferencia finita de temperaturas. El calor se derrama por la habitación como el agua que cae por una cascada. Pero al igual que en la cascada se puede colocar una central hidroeléctrica, entre la salida de calor del bloque y su llegada a la habitación se podría poner una máquina térmica reversible que aprovechara parte del calor para producir trabajo útil.
En un momento dado el bloque se encontrará a una temperatura T y cederá reversiblemente un calor − mcpdT (el signo porque la temperatura disminuye, dT es negativo, pero el calor cedido es positivo respecto de la máquina). Con ese calor la máquina hará un trabajo también diferencial
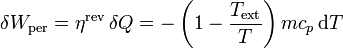
siendo Text la temperatura del exterior de la habitación (5°C), ya que obtendremos más trabajo si empleamos un foco frío a menor temperatura.
Integrando obtenemos el trabajo perdido, que podríamos haber aprovechado con esta máquina térmica
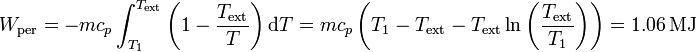
esto es, podríamos haber aprovechado el 25% del calor cedido. Este trabajo aprovechable es la exergía del sistema.
5 Máximo aprovechamiento
La solución óptima entonces no es colocar el bloque en la habitación, sino dejarlo que se enfríe en el exterior. Pero el calor que pierde no dejarlo que se pierda en el ambiente, sino usarlo para alimentar una máquina térmica reversible que produciría el trabajo hallado en el apartado anterior.
Ahora, este trabajo se emplea para hacer funcionar una bomba de calor también reversible que absorbe calor desde el exterior de la habitación, a 5°C, hasta el interior, a 22°C.
El coeficiente de desempeño de esta bomba de calor sería
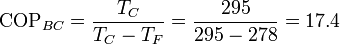
Por tanto, el calor que meteríamos en la habitación sería
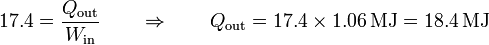
Es decir, obtendríamos una cantidad de calor de 18.4 MJ, que supone 4.6 veces el calor por calentamiento directo (4.01 MJ). Este valor de 18.4 MJ es el máximo posible en las condiciones del problema, ya que se ha obtenido con procesos puramente reversibles.





