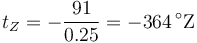Preguntas de test de introducción a la termodinámica (GIE)
De Laplace
1 Temperatura de un gas
Un gas ideal diatómico contenido en un recipiente ocupa un volumen de 500 cm³ a una presión de 4.0 bares y 300 K de temperatura. Experimenta una expansión hasta un estado final en el que ocupa un volumen de 1000 cm³ a una presión de 1.0 bares.
¿Cuál es la temperatura final del gas?
- A 150 K
- B Depende de si las paredes son adiabáticas o diatermas.
- C 75 K
- D 600 K
- Solución
La respuesta correcta es la A.
La ley de los gases ideales da
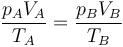
de donde la temperatura final es
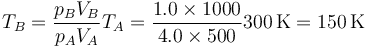
2 Temperatura en un proceso
Se tiene una cantidad fija de un gas ideal diatómico situada a una presión p0, volumen V0 y temperatura T0. Experimenta un proceso tal que la presión final es 2p0 y el volumen 2V0.
En este proceso, la temperatura…
- A permanece constante.
- B se reduce a la mitad.
- C aumenta al doble.
- D se multiplica por 4.
- Solución
La respuesta correcta es la D.
Como en la pregunta anterior, aplicamos la ley de los gases ideales
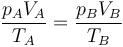
que en este caso da
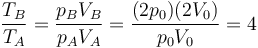
3 Número de psi en una atmósfera
Una atmósfera equivale a 101325 Pa. Un psi es la presión ejercida por una libra (4.448 N) sobre un cuadrado de lado 1 pulgada (2.54 cm). ¿A cuantos psi equivale una atmósfera?
- A 1 atm = 579 psi
- B 1 atm = 1.50 psi
- C 1 atm = 6894 psi
- D 1 atm = 14.7 psi
- Solución
La respuesta correcta es la D.
La equivalencia de psi en pascales la obtenemos mediante factores de conversión
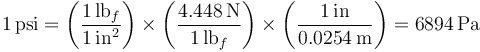
Puesto que una atmósfera son 101325 pascales queda
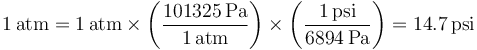
4 Título de una novela en Celsius
En el paso de grados Celsius a Fahrenheit se cumple 0°C = 32°F y 100°C = 212 °F. El título de la novela Fahrenheit 451 se refiere a la temperatura a la que arde el papel. ¿Cómo quedaría este título en la escala Celsius?
- A Celsius 844
- B Celsius 213
- C Celsius 251
- D Celsius 233
- Solución
La respuesta correcta es la D.
La relación entre la temperatura en grados Celsius y en grados Fahrenheit es lineal
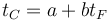
donde los coeficientes los sacamos de que conocemos dos puntos fijos

de donde
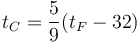
Sustituyendo aquí el valor de la temperatura de combustión del papel
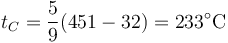
5 Densidad del aire húmedo
El aire seco (sin vapor de agua) equivale a un gas ideal de peso molecular 29 g/mol. El agua tiene peso molecular de 18 g/mol. El aire húmedo es el que tiene una cierta cantidad de vapor de agua. A 1 atm y 300 K, ¿qué aire es más denso, el seco o el húmedo?
- A Los dos tienen la misma densidad.
- B El seco.
- C Depende de la humedad del aire.
- D El húmedo.
- Solución
La respuesta correcta es la B.
Para una presión y temperatura dadas, el número de moles por unidad de volumen esta fijado (según la ley de los gases ideales u otra más complicada en el caso no ideal). Esto quiere decir que el número de moléculas está fijado.
Entonces, cuando entra humedad en el aire seco, las moléculas de agua entran “en lugar de”, no “además de”, es decir, que para mantener constante la presión, por cada molécula de agua que entra, se desaloja una de oxígeno o una de nitrógeno.
Ahora bien, el peso molecular del oxígeno es 32 g/mol y el del nitrógeno 28 g/mol, siendo el del agua solo 18 g/mol. Por tanto, estamos sustituyendo algunas moléculas por otras más ligeras. Consecuentemente, la masa por unidad de volumen, es decir, la densidad, disminuye.
El aire húmedo es entonces más ligero que el aire seco a la misma presión y temperatura.
6 Propiedad termométrica
Se tiene un sistema cerrado que contiene un gas ideal cuya temperatura puede cambiar. ¿Cuál de las siguientes propiedades no nos sirve para construir una escala para un termómetro?
- A El número de moles.
- B La energía interna.
- C La presión.
- D El volumen.
- Solución
La respuesta correcta es la A.
Según la ley de los gases ideales, cuando se cambia la temperatura, cambia la presión o el volumen. También cambia la energía interna, que depende solo de la temperatura.
Lo único que no cambia con la temperatura es el número de moles, que simplemente nos indica cuantas moléculas hay en el gas. Por ello, el número de moles no se puede usar como propiedad termométrica (que debe ser una función de T).
7 Dilatación de un paralelepípedo
El coeficiente de dilatación lineal del oro a 20 °C es 14×10−6°C−1. Si se tiene un paralelepípedo de oro que a 20 °C ocupa 500 cm³, ¿cuánto aumenta el volumen cuando se calienta hasta 30 °C?
- A 210 mm³
- B 140 mm³
- C 70 mm³
- D 7 mm³
- Solución
La respuesta correcta es la A.
La variación lineal de un sólido la da la ley de dilatación
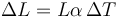
y la volumétrica es
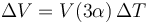
que en este caso vale
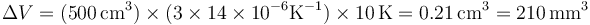
8 Volumen de gasolina
Una cierta cantidad de gasolina ocupa 1000 cm³ a 20 °C y 1019 cm³ a 40 °C. ¿Qué volumen ocupa a 80 °C?
- A 1095 cm³
- B 1057 cm³
- C 1038 cm³
- D 1076 cm³
- Solución
La respuesta correcta es la B.
La dilatación de un solido o un líquido es aproximadamente lineal con la temperatura
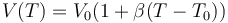
lo que nos permite calcular el coeficiente de dilatación β

y aplicándolo ahora a la temperatura solicitada
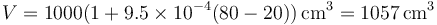
De forma más simple, el cálculo es que si subiendo 20 grados aumenta en 19cm³, subiendo 60°C aumenta el triple.
9 Proceso en un gas
Un gas ideal diatómico ocupa un cierto volumen V0 a una presión p0 y una temperatura T0. Primero, manteniendo constante su volumen, se reduce lentamente su presión a p0 / 2. Luego, manteniendo constante su nueva presión, se pone gradualmente en contacto con un foco a temperatura T0. ¿Como se relacionan el volumen inicial, V0, y final Vf, del gas?
- A Vf = V0
- B Vf = V0 / 2
- C Vf = 2V0
- D Vf = 4V0
- Solución
La respuesta correcta es la C.
Es simple aplicación de la ley de los gases ideales
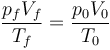
que nos da
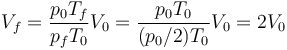
Nótese que el estado final es independiente del proceso.
10 Dilatación de raíles
Los raíles ferroviarios son de acero y tienen 18 m de longitud a 20°C. Si deben operar entre -10°C y 60°, ¿qué espacio debe dejarse como mínimo entre un tramo y el siguiente si se tienden a una temperatura de 20°?
- A 1 cm
- B 2 cm
- C 2 mm
- D 5 mm
Dato: Coeficiente de dilatación lineal del acero: 13×10−6K−1
- Solución
La respuesta correcta es la A.
Aplicando la ley de la dilatación lineal
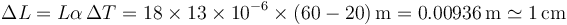
Nótese que hay que considerar toda la dilatación lineal de los 18m, y no la mitad (considerando que el raíl se expande en los dos sentidos) ni el doble (considerando que hay dos raíles, uno a continuación del otro). Los dos factores se cancelan. Cada raíl se dilatará 5mm a cada lado, pero al ser dos raíles sucesivos, el espaciado debe ser 5mm + 5mm = 1cm.
11 Dilatación de tapa
Una forma de abrir un bote de vidrio cuya tapa metálica está demasiado apretada consiste en sumergirlo en un baño de agua caliente. Si sumergimos en agua a 60 °C un bote de 4.0 cm de radio con tapa de estaño que a 20 °C encaja perfectamente y el coeficiente de dilatación lineal del vidrio es 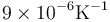 y el del estaño es
y el del estaño es 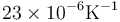 , ¿cuánta holgura queda al calentarlo?
, ¿cuánta holgura queda al calentarlo?
- A 22 μm
- B 560 μm
- C 37 μm
- D 920 μm
- Solución
La respuesta correcta es la A.
Aplicamos la ley de dilatación a los radios
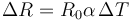
puesto que inicialmente los dos tienen el mismo radio y el incremento de temperatura es el mismo para vidrio y tapa, podemos hallar la diferencia entre los diámetros como
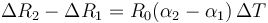
Sustituimos los valores numéricos
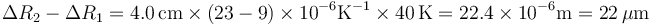
12 Escala de temperaturas basada en el metano
Zorg, un habitante de Titán, construye una escala de temperaturas basada en el metano tal que a la fusión (91 K) le corresponden 0 °Z y a la ebullición (116 K) 100 °Z. ¿Cuál es la temperatura del cero absoluto en esta escala?
- A −187 °Z
- B −364 °Z
- C −91 °Z
- D −25 °Z
- Solución
La respuesta correcta es la B.
La relación entre las dos escalas de temperatura es lineal
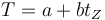
Hallamos a y b de los dos puntos conocidos

de donde

por lo que la relación es
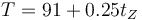
Para T = 0 queda