Ciclo Otto
De Laplace
Contenido |
1 Enunciado
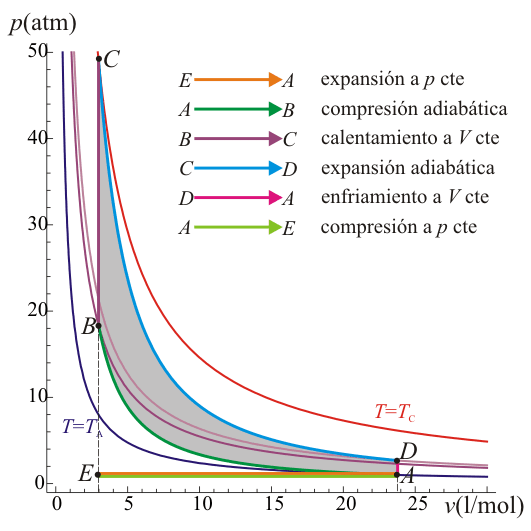
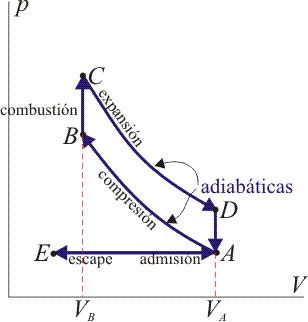
Un ciclo Otto ideal modela el comportamiento de un motor de explosión. Este ciclo está formado por seis pasos, según se indica en la figura. Pruebe que el rendimiento de este ciclo viene dado por la expresión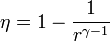
siendo r = VA / VB la razón de compresión igual al cociente entre el volumen al inicio del ciclo de compresión y al final de él. Para ello, halle el rendimiento a partir del calor que entra en el sistema y el que sale de él; exprese el resultado en términos de las temperaturas en los vértices del ciclo y, con ayuda de la ley de Poisson, relacione este resultado con los volúmenes VA y VB.
2 Descripción del ciclo
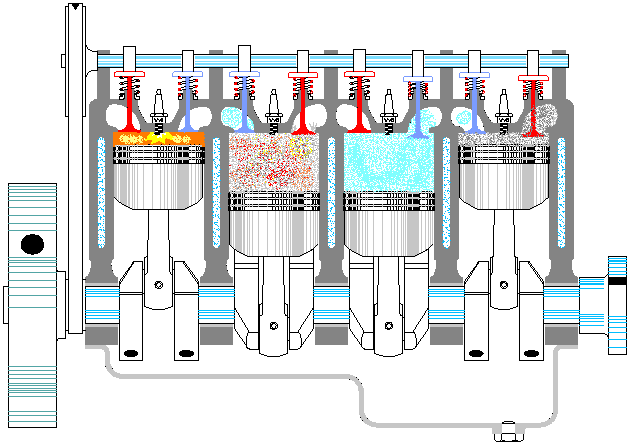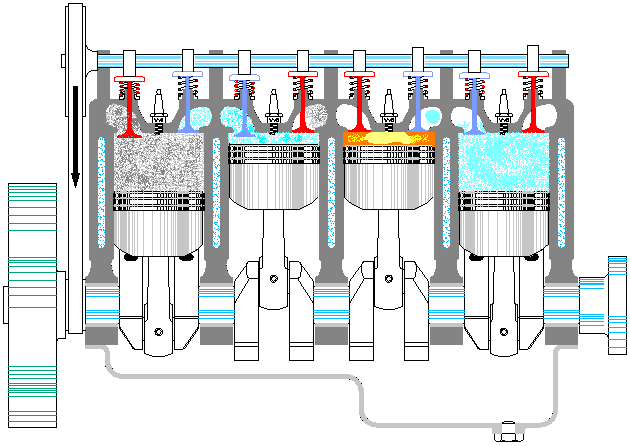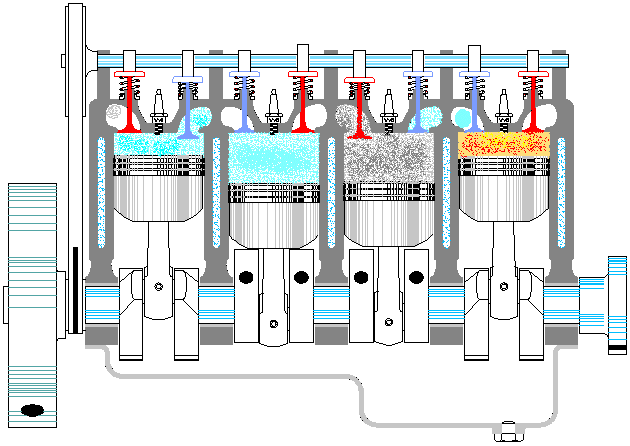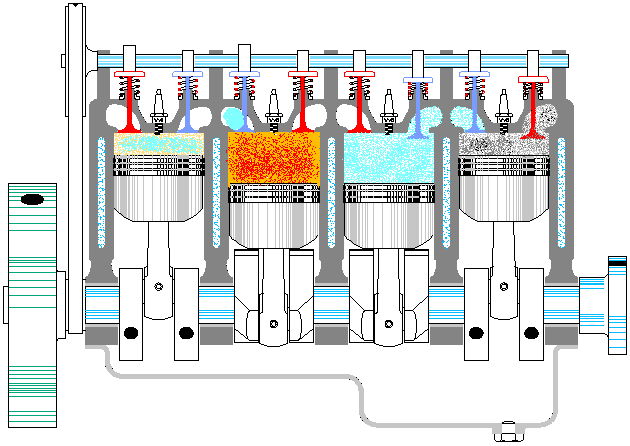
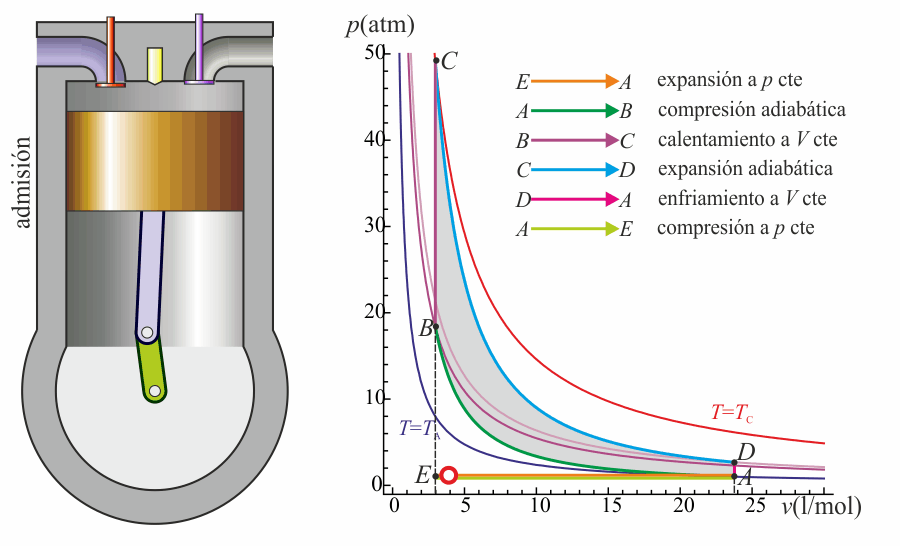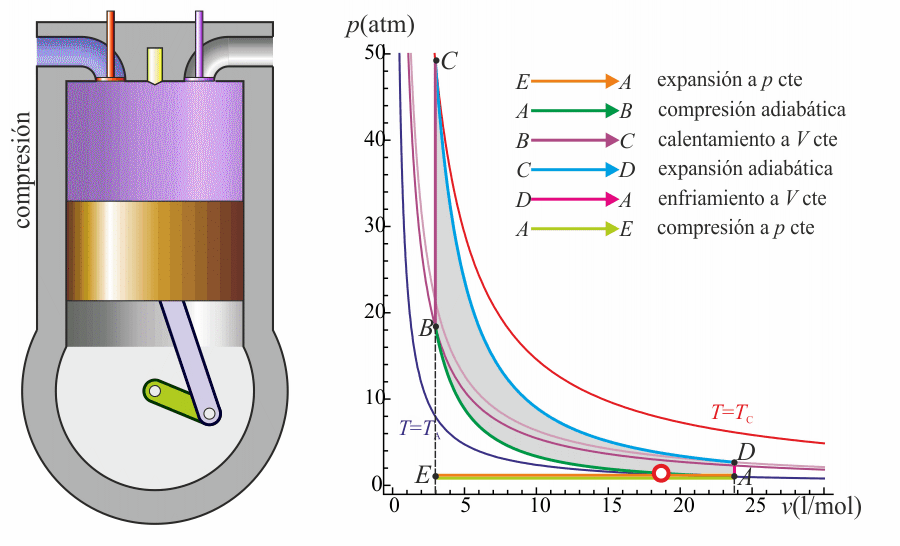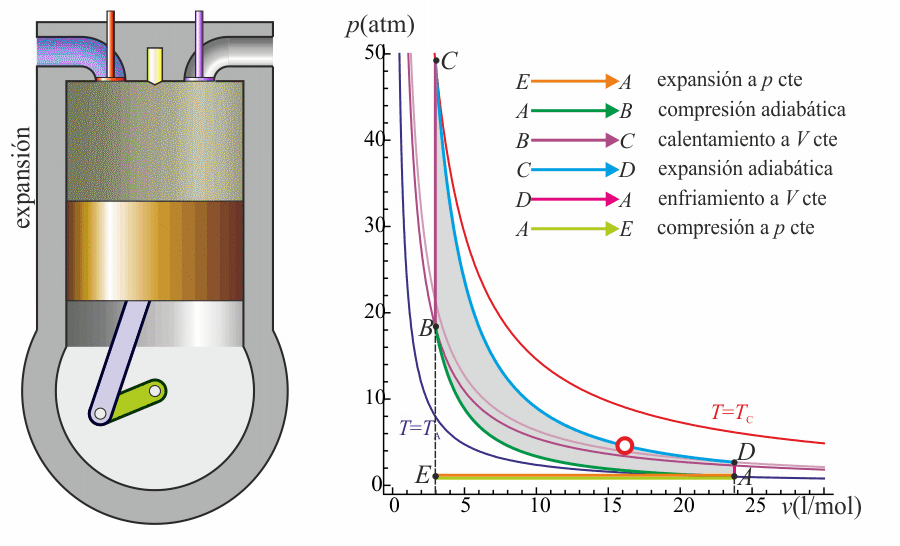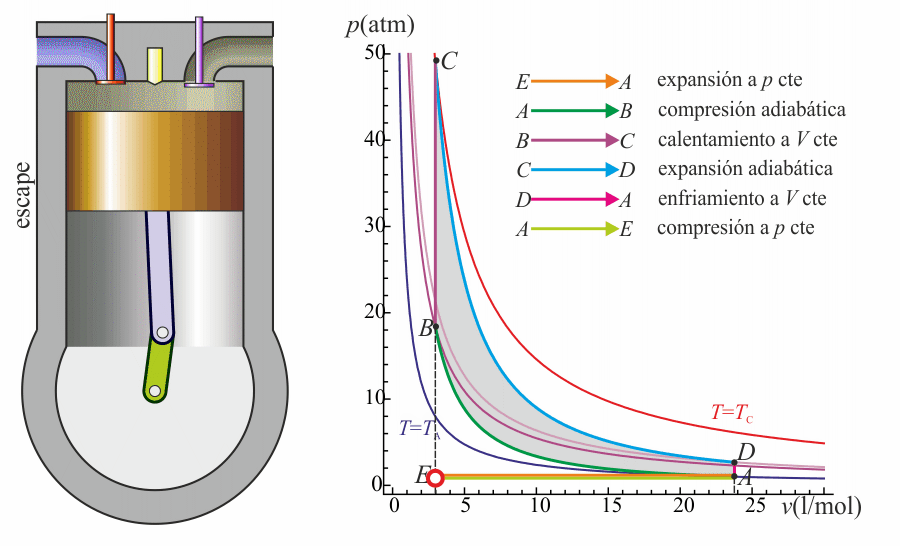
Un ciclo Otto ideal es una aproximación teórica al comportamiento de un motor de explosión. Las fases de operación de este motor son las siguientes:- Admisión (1)
- El pistón baja con la válvula de admisión abierta, aumentando la cantidad de mezcla (aire + combustible) en la cámara. Esto se modela como una expansión a presión constante (ya que al estar la válvula abierta la presión es igual a la exterior). En el diagrama PV aparece como la línea recta E→A.
- Compresión (2)
- El pistón sube comprimiendo la mezcla. Dada la velocidad del proceso se supone que la mezcla no tiene posibilidad de intercambiar calor con el ambiente, por lo que el proceso es adiabático. Se modela como la curva adiabática reversible A→B, aunque en realidad no lo es por la presencia de factores irreversibles como la fricción.
- Combustión
- Con el pistón en su punto más alto, salta la chispa de la bujía. El calor generado en la combustión calienta bruscamente el aire, que incrementa su temperatura a volumen prácticamente constante (ya que al pistón no le ha dado tiempo a bajar). Esto se representa por una isócora B→C. Este paso es claramente irreversible, pero para el caso de un proceso isócoro en un gas ideal el balance es el mismo que en uno reversible.
- Expansión (3)
- La alta temperatura del gas empuja al pistón hacia abajo, realizando trabajo sobre él. De nuevo, por ser un proceso muy rápido se aproxima por una curva adiabática reversible C→D.
- Escape (4)
- Se abre la válvula de escape y el gas sale al exterior, empujado por el pistón a una temperatura mayor que la inicial, siendo sustituido por la misma cantidad de mezcla fría en la siguiente admisión. El sistema es realmente abierto, pues intercambia masa con el exterior. No obstante, dado que la cantidad de aire que sale y la que entra es la misma podemos, para el balance energético, suponer que es el mismo aire, que se ha enfriado. Este enfriamiento ocurre en dos fases. Cuando el pistón está en su punto más bajo, el volumen permanece aproximadamente constante y tenemos la isócora D→A. Cuando el pistón empuja el aire hacia el exterior, con la válvula abierta, empleamos la isobara A→E, cerrando el ciclo.
En total, el ciclo se compone de dos subidas y dos bajadas del pistón, razón por la que se le llama motor de cuatro tiempos.
En un motor real de explosión varios cilindros actúan simultáneamente, de forma que la expansión de alguno de ellos realiza el trabajo de compresión de otros.
3 Eficiencia en función del calor
Al analizar el ciclo Otto ideal, podemos despreciar en el balance los procesos de admisión y de escape a presión constante A→E y E→A, ya que al ser idénticos y reversibles, en sentido opuesto, todo el calor y el trabajo que se intercambien en uno de ellos, se cancela con un término opuesto en el otro.
3.1 Intercambio de calor
De los cuatro procesos que forman el ciclo cerrado, no se intercambia calor en los procesos adiabáticos A→B y C→D, por definición. Sí se intercambia en los dos procesos isócoros.
- En la ignición de la mezcla B→C, una cierta cantidad de calor Qc (procedente de la energía interna del combustible) se transfiere al aire. Dado que el proceso sucede a volumen constante, el calor coincide con el aumento de la energía interna
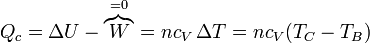
- El subíndice "c" viene de que este calor se intercambia con un supuesto foco caliente.
- En la expulsión de los gases D→A el aire sale a una temperatura mayor que a la entrada, liberando posteriormente un calor | Qf | al ambiente. En el modelo de sistema cerrado, en el que nos imaginamos que es el mismo aire el que se comprime una y otra vez en el motor, modelamos esto como que el calor | Qf | es liberado en el proceso D→A, por enfriamiento. El valor absoluto viene de que, siendo un calor que sale del sistema al ambiente, su signo es negativo. Su valor, análogamente al caso anterior, es
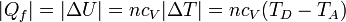
- El subíndice "f" viene de que este calor se cede a un foco frío, que es el ambiente.
3.2 Trabajo realizado
De forma opuesta a lo que ocurre con el calor, no se realiza trabajo sobre el sistema en los dos procesos isócoros. Sí se realiza en los dos adiabáticos.
- En la compresión de la mezcla A→B, se realiza un trabajo positivo sobre el gas. Al ser un proceso adiabático, todo este trabajo se invierte en incrementar la energía interna, elevando su temperatura:
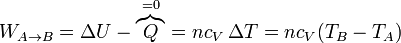
- En la expansión C→D es el aire el que realiza trabajo sobre el pistón. De nuevo este trabajo útil equivale a la variación de la energía interna
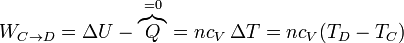
- este trabajo es negativo, por ser el sistema el que lo realiza.
- El trabajo útil realizado por el motor será el trabajo neto entregado, igual a lo que produce (en valor absoluto) menos lo que emplea en funcionar
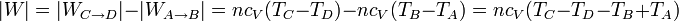
Por tratarse de un proceso cíclico, la variación de la energía interna es nula al finalizar el ciclo. Esto implica que el calor neto introducido en el sistema debe ser igual al trabajo neto realizado por este, en valor absoluto.
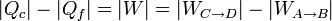
como se comprueba sustituyendo las relaciones anteriores.
3.3 Rendimiento
El rendimiento (o eficiencia) de una máquina térmica se define, en general como “lo que sacamos dividido por lo que nos cuesta”. En este caso, lo que sacamos es el trabajo neto útil, | W | . Lo que nos cuesta es el calor Qc, que introducimos en la combustión. No podemos restarle el calor | Qf | ya que ese calor se cede al ambiente y no es reutilizado (lo que violaría el enunciado de Kelvin-Planck). Por tanto
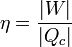
Sustituyendo el trabajo como diferencia de calores
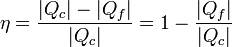
Esta es la expresión general del rendimiento de una máquina térmica.
4 Eficiencia en función de las temperaturas
Sustituyendo las expresiones del calor que entra en el sistema, | Qc | , y el que sale de él, | Qf | , obtenemos la expresión del rendimiento
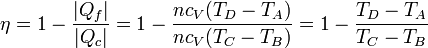
Vemos que el rendimiento no depende de la cantidad de aire que haya en la cámara, ya que n se cancela.
Podemos simplificar estas expresiones observando que B→C y D→A son procesos isócoros, por lo que
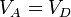
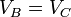
y que A→B y C→D son adiabáticos, por lo que cumplen la ley de Poisson (suponiéndolos reversibles)
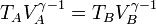
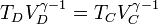
con γ = 1.4 la relación entre las capacidades caloríficas a presión constante y a volumen constante. Sustituyendo la igualdad de volúmenes
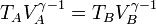
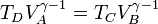
y dividiendo la segunda por la primera, obtenemos la igualdad de proporciones
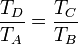
Restando la unidad a cada miembro
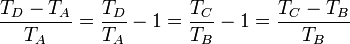
Intercambiando el denominador del primer miembro, con el numerador del último llegamos a
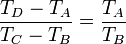
y obtenemos finalmente el rendimiento
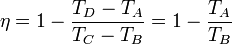
esto es, la eficiencia depende solamente de la temperatura al inicio y al final del proceso de compresión, y no de la temperatura tras la combustión, o de la cantidad de calor que introduce ésta.
Puesto que TB < TC, siendo TC la temperatura máxima que alcanza el aire, vemos ya que este ciclo va a tener un rendimiento menor que un ciclo de Carnot que opere entre esas las temperaturas TA y TC.
5 Eficiencia en función de la razón de compresión
Aplicando de nuevo la relación de Poisson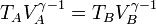
podemos expresar el rendimiento como
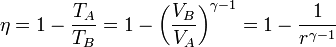
con r = VA / VB la razón de compresión entre el volumen inicial y el final.
La eficiencia teórica de un ciclo Otto depende, por tanto, exclusivamente de la razón de compresión. Para un valor típico de 8 esta eficiencia es del 56.5%.
6 Ejemplo práctico
Supongamos un ciclo Otto ideal con una relación de compresión de 8. Al inicio de la fase de compresión, el aire está a 100 kPa y 17°C. En la combustión se añaden 800 kJ/kg de calor. Vamos a determinar la temperatura y la presión máximas que se producen en el ciclo, la salida de trabajo neto y el rendimiento de este motor.6.1 Temperatura máxima
El aire contenido en el motor se calienta en dos fases: durante la compresión y como consecuencia de la ignición.
En la compresión, obtenemos la temperatura final aplicando la ley de Poisson
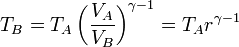
Sustituyendo los valores numéricos
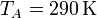
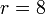
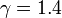

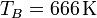
El segundo incremento de temperatura se produce como resultado de la combustión de la gasolina. De acuerdo con los datos, la cesión de calor es de 800 kJ por kg de aire, esto es, es un dato relativo. Obtenemos el incremento de temperatura como
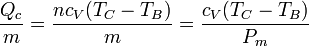
siendo
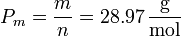
el peso molecular medio del aire. Despejando y sustituyendo
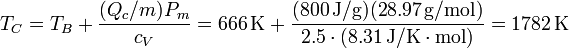
Vemos que en la combustión la temperatura crece el triple que en la compresión.
6.2 Presión máxima
La presión también se incrementa en dos fases, pero para hallar la presión máxima no necesitamos calcular los incrementos por separado. Nos basta con hallar la presión en el punto C y esto lo podemos hacer aplicando la ley de los gases ideales
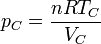
El volumen en C es el mismo que en B y este lo sacamos del volumen A mediante la razón de compresión
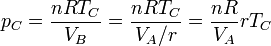
Aplicando de nuevo la ley de los gases ideales obtenemos finalmente
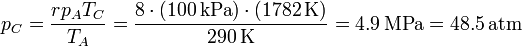
Tanto en el cálculo de la temperatura como en el de la presión máxima hemos usado la aproximación de que la capacidad calorífica molar del aire es la misma a todas las temperaturas. Un cálculo preciso requiere usar las tablas empíricas de variación de cV con T y los resultados correctos pueden diferir en torno a un 10%.
6.3 Rendimiento
El rendimiento de un ciclo Otto ideal con una razón de compresión de 8 es
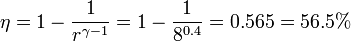
Cuando se tiene en cuenta que la capacidad calorífica varía con la temperatura, resulta un valor inferior para el rendimiento, en torno al 52%.
6.4 Trabajo neto
El trabajo neto (por unidad de masa) lo podemos obtener conocidos el calor que entra y el rendimiento del ciclo
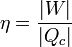

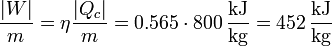
No obstante, podemos desglosar el cálculo, hallando cuánto cuesta comprimir el aire, y cuanto trabajo devuelve el gas en la expansión.
El trabajo de compresión por unidad de masa es
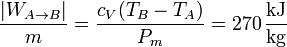
y el devuelto en la expansión
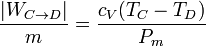
La temperatura en el punto D no la conocemos, pero la podemos calcular sabiendo que los puntos C y D están unidos por una adiabática
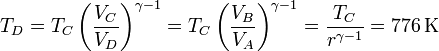
y resulta un trabajo de expansión
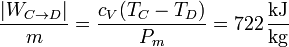
El trabajo neto, igual al que desarrolla el gas, menos lo que cuesta comprimirlo es
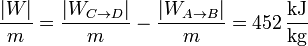
7 Límites prácticos
El cálculo anterior establece un límite máximo para la eficiencia de un motor de explosión. De acuerdo con esta expresión la forma de aumentar el rendimiento es incrementar la razón de compresión r. Sin embargo, esta razón no se puede incrementar indefinidamente. Uno de los motivos es que al comprimir el gas este se calienta, siendo su temperatura al final de la compresión
si esta temperatura es lo suficientemente alta, puede producirse la autoignición, en la cual la gasolina se quema espontáneamente (como el gasóleo en un ciclo Diesel) antes de que salte la chispa de la bujía. Esto tiene efectos destructivos para el motor, por lo que debe ser evitado. Para evitar la autoignición puede usarse gasolina de mayor octanaje, o emplear aditivos, como algunos derivados del plomo, hoy prohibidos.
Una segunda fuente de limitación lo da el que el ciclo Otto ideal es solo una aproximación al ciclo real. En el ciclo real los procesos son curvas más suaves, correspondientes además a procesos irreversibles

Entre los efectos irreversibles no considerados en el ciclo ideal destaca la fricción del émbolo con el cilindro. Esta fricción disipa energía por calentamiento (que en ausencia de aceite llega a gripar el motor, por fusión de las piezas). Por todo ello, el rendimiento de un motor de explosión real puede estar en torno al 25% o 30%.
8 Enlaces
- Artículo sobre el ciclo Otto en el curso de Termodinámica del MIT.