Termómetro con dos cámaras
De Laplace
Contenido |
1 Enunciado
(Final Julio 2009, P4)
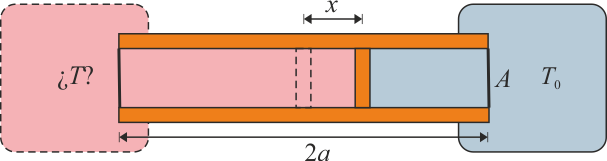
Se construye un termómetro de gas ideal según el siguiente principio: un tubo cilíndrico de sección A y longitud 2a con paredes adiabáticas y bases diatermas es dividido por un pistón, también adiabático, que puede deslizarse sin rozamiento por el interior del tubo. En el interior de las dos cámaras se encuentra un gas ideal. Una de las dos cámaras se mantiene en contacto térmico con un foco a temperatura T0, mientras que la otra se pone en contacto con el sistema cuya temperatura se quiere medir. Cuando las dos temperaturas son iguales el pistón se encuentra en la posición central y la presión del gas es p0.
- Calcule la temperatura absoluta T a la que se encuentra el sistema cuando el pistón se ha desplazado una cantidad x desde el centro hacia el sistema a T0. ¿Resulta una escala lineal de temperaturas? ¿A cuánto tiende x si
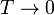 o si
o si 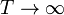 ?
?
- Supongamos que se parte del equilibrio a T0 y que la variación de la temperatura del gas de la cámara exterior y el desplazamiento del pistón en x ha sido de forma cuasiestática y reversible. ¿Cuáles son los calores, trabajos e incrementos de energía interna para cada una de las cámaras y para el tubo completo, como función del desplazamiento x del pistón?
- Supongamos que el tubo mide 20 cm, la temperatura de referencia es T0 = 300 K y el pistón se desplaza 1 cm. ¿Cuál es la temperatura del sistema exterior?
- Si además sabemos que la sección del tubo es de 10 cm2 , el gas contenido es aire y la presión inicial es p0 = 100 kPa, ¿cuánto valen los calores, trabajos e incrementos de energía interna del segundo apartado?
Dato: La constante de los gases ideales es R = 8.314 J/mol · K.
2 Escala de temperaturas
Nuestro sistema es el cilindro con las dos cámaras. Este sistema intercambia calor de dos modos. La cámara derecha cede o absorbe calor del foco a temperatura constante T0, de modo que la temperatura de esta cámara es siempre T0. La cámara de la izquierda intercambia calor con el sistema del que se quiere medir la temperatura. Es decir, ninguna de las dos cámaras es adiabática. Los procesos en la cámara de la derecha son isotermos, mientras que los de la izquierda no mantienen ninguna magnitud termodinámica constante.
Para medir la temperatura de un sistema ponemos en contacto la cámara izquierda con él. El trasvase de calor que se produce hace que varíe el estado del gas en esta cámara, por lo que se altera el valor de la presión. Entonces, el pistón se desplaza, con lo cual cambia el volumen de los dos gases. El equilibrio se recupera cuando la presión a ambos lados del pistón sea la misma. Los dos gases tendrán en general temperaturas distintas pues el pistón es adiabático y no permite el paso de calor.
Cuando las temperaturas son iguales en ambas cámaras el pistón está en el centro del cilindro y el volumen ocupado por los dos gases es el mismo
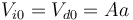
Como la temperatura de los dos gases en este caso es T0 y la presión es p0, el número de moles es el mismo en las dos cámaras
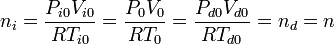
Si el pistón se desplaza hacia la derecha, el volumen de la cámara izquierda aumenta y el de la derecha disminuye
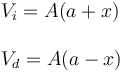
Cuando el pistón se desplaza hacia la izquierda los valores de x son negativos, con lo que estas expresiones también dan el valor correcto del volumen ocupado por cada gas.
Al poner en contacto el gas de la izquierda con el sistema a temperatura T el nuevo equilibrio se alcanza cuando las presiones en los dos gases son iguales. En ese instante
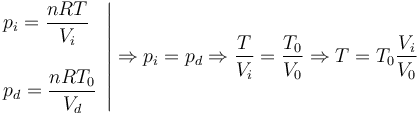
Usando las expresiones que nos dan los volúmenes en función de x, teniendo en cuenta que el área S aparece en el numerador y el denominador obtenemos
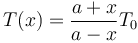
Está función no es lineal, pues su gráfica no corresponde a una línea recta.
Para examinar los límites propuestos en el enunciado despejamos x en función de T
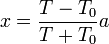
Cuando 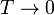 obtenemos
obtenemos 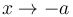 . Si el sistema exterior está muy frío el pistón tiende
a situarse en el extremo izquierdo. En el otro límite, si
. Si el sistema exterior está muy frío el pistón tiende
a situarse en el extremo izquierdo. En el otro límite, si 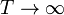 se tiene
se tiene 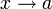 . Si
el sistema está muy caliente el pistón se desplaza hacia la derecha.
. Si
el sistema está muy caliente el pistón se desplaza hacia la derecha.
La figura muestra como depende la temperatura medida con la posición del émbolo. Pueden apreciarse los dos límites que hemos calculado.
3 Energía interna, calor y trabajo
Examinamos ahora los trasvases de calor, trabajo y variación de energía interna en el proceso termodinámico en cuestión. Suponemos que en el estado inicial la temperatura de ambos gases es T0, por lo que los volúmenes son iguales. El proceso es cuasiestático, esto es, los gases de las dos cámaras están siempre en equilibrio, es decir, a la misma presión. Como el gas de la derecha está siempre a la temperatura T0 el proceso en él es isotermo. Analizamos primero este pues es el más sencillo
3.1 Gas en la cámara derecha
Al ser iguales las temperaturas inicial y final, la energía interna del gas no cambia (es un gas ideal)
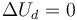
Podemos calcular el trabajo que realiza el pistón sobre el gas pues el proceso es isotermo
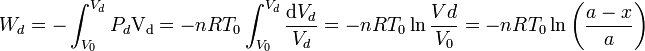
El Primer Principio de la Termodinámica nos dice que ΔU = Q + W. Como ΔU = 0 nos queda
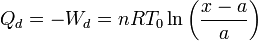
3.2 Gas en la cámara izquierda
Al ser un gas ideal la variación de energía interna depende únicamente de la temperatura. Entonces
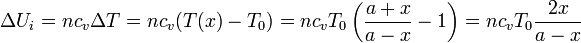
El trabajo es más difícil de calcular pues en este caso ninguna magnitud se mantiene constante. Podemos hacerlo si observamos que la presión en los dos gases es siempre la misma y que lo que aumenta el volumen de un lado es igual a lo que disminuye el volumen del otro.
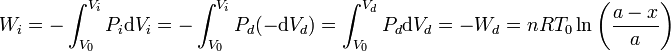
Este resultado también puede obtenerse si nos damos cuenta de que el trabajo sobre el sistema total es nulo, pues el volumen total del cilindro no cambia. Entonces, el trabajo que el gas de la izquierda realiza sobre el de la derecha debe ser igual al que el gas de la derecha realiza sobre el de la izquierda, cambiado de signo.
El calor que absorbe el gas de la izquierda lo obtenemos de la aplicación del Primer Principio
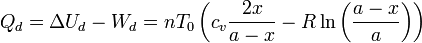
3.3 Tubo completo
La variación de energía interna es la suma de la variación en cada gas
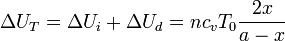
Como el volumen total del cilindro no cambia, el trabajo total es cero
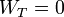
El calor total transferido lo obtenemos aplicando el Primer Principio
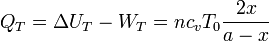
La imagen muestra donde se realizan los trabajos y se producen las transferencias de calor en el sistema
4 Cálculo numérico de la temperatura
De los datos del enunciado se deduce a = 10 cm y x = 1 cm. Si T0 = 300 K tenemos
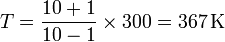
5 Cálculo numérico de calores, trabajos y variaciones de energía interna
Al ser aire el gas puede considerarse diatómico, es decir, cv = 5R / 2. El volumen inicial es
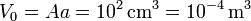 . La presión inicial es
. La presión inicial es
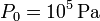 . Con estos datos podemos calcular los valores numéricos pedidos.
. Con estos datos podemos calcular los valores numéricos pedidos.
5.1 Gas en la cámara derecha
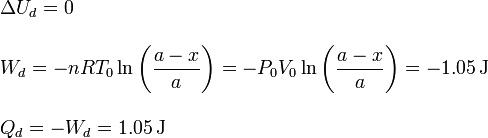
5.2 Gas en la cámara izquierda
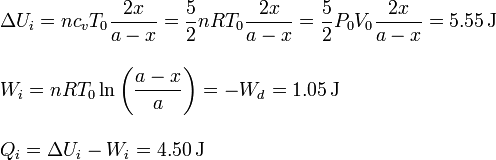
5.3 Tubo completo
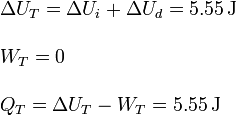
6 Errores comunes
- Por definición, un termómetro no puede ser adiabático. Para poder medir la temperatura de un sistema ha de intercambiar calor con él, para poder alcanzar el equilibrio térmico. No había ningún proceso adiabático en el problema.
- Hay que saber identificar el sistema y el entorno. En este caso el sistema era el cilindro con las dos cámaras y el entorno el foco a temperatura T0 y el sistema a temperatura T.
- El proceso en la cámara izquierda no mantiene ninguna magnitud constante. Ni la presión, ni la temperatura y, por supuesto, tampoco el volumen. El trabajo sobre el gas de la izquierda es igual al trabajo sobre el de la derecha cambiado de signo.