Comparación de dos variaciones de entropía
De Laplace
Contenido |
1 Enunciado
Calcule la variación de entropía en las dos situaciones siguientes:
- 100 ml de agua a 80°C son vertidos en un tanque de agua a 20°C.
- 100 ml de agua a 20°C son vertidos en un tanque de agua a 80°C.
Suponga que la presión es la atmosférica en todo momento.
2 Solución general
Los dos fenómenos son del mismo tipo: una cierta cantidad de sustancia a una temperatura Ti es puesta en contacto con un baño térmico a una temperatura Tf. Como resultado, la temperatura de la sustancia cambia hasta igualarse con la del baño. En el proceso se produce una transferencia de calor y una variación en la entropía del universo.
Para hallar esta variación separamos en la variación de la entropía del sistema, del baño y la total.
3 Variación de entropía del ambiente
Cuando el agua del sistema se enfría o se calienta intercambia una cierta cantidad de calor igual a
Puesto que el proceso ocurre a presión constante, el trabajo realizado sobre el sistema no es nulo, sino que vale − pΔV. Para incluirlo en los cálculos, en lugar de la energía interna usamos la entalpía H = U + pV. A presión constante, el calor equivale a la variación de la entalpía, y es proporcional a la variación de la temperatura
siendo 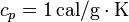 el calor específico del agua (por unidad de masa).
el calor específico del agua (por unidad de masa).
Este calor es negativo si el sistema se enfría (pues en realidad sale del sistema) y positivo si se calienta.
El calor que entra en el ambiente es este mismo, cambiado de signo
Esta entrada de calor se produce a una temperatura constante (en el ambiente) Tf, por lo que el aumento de entropía del ambiente es

4 Variación de entropía del sistema
El proceso que se describe en este ejemplo es irreversible, ya que se debe a una cesión de calor debida a una diferencia finita de temperaturas. Al verter el agua, el cambio de temperatura se producirá en general de una forma complicada. Sin embargo, al ser tanto el estado inicial como el final estados de equilibrio, podemos calcular la variación de entropía suponiendo un proceso reversible que conecte estos dos mismos estados.
Este proceso reversible sería una variación gradual y uniforme de la temperatura, de forma que en todo momento el agua vertida se supone en equilibrio térmico. Para realizar este proceso necesitaríamos una cantidad infinita de baños térmicos, cada uno a una temperatura ligeramente diferente al siguiente, de forma que situaríamos al agua en contacto sucesivo con cada uno de ellos. Por supuesto, este proceso es irrealizable en la práctica, pero nos basta para hallar el cambio de entropía.
La variación de entropía cuando el agua pasa de una temperatura T a una T + dT es
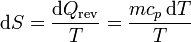
Si suponemos que el calor específico no depende de la temperatura, podemos integrar esta ecuación y obtener el incremento de entropía
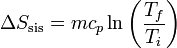
5 Variación de entropía total
Sumando las dos contribuciones obtenemos la variación de entropía total del universo.
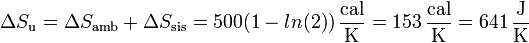
(0, más exactamente, 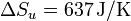 ). La variación neta es positiva pues estamos considerando un proceso irreversible.
). La variación neta es positiva pues estamos considerando un proceso irreversible.





