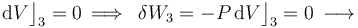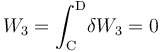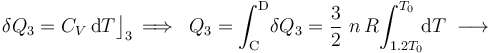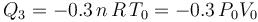Proceso cíclico reversible de un gas ideal (F2GIA)
De Laplace
Contenido |
1 Enunciado
Un sistema termodinámico consistente en n moles de un gas ideal monoatómico realiza un proceso cíclico. Inicialmente se encuentra en un estado “A” caracterizado por la terna de valores de presión, volumen y temperatura {P0,V0,T0}. La fase “1” del ciclo consiste en un proceso isócoro (a volumen constante) hasta el estado “B”, en el cuál su temperatura tiene un valor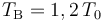 . En la fase “2” se expande isotérmicamente (a temperatura constante), hasta recuperar la presión inicial P0 en el estado “C”. A continuación realiza otro proceso isócoro “3” hasta el estado “D” para, finalmente, realizar un nuevo proceso isotermo “4” que termina en el estado “A”, completando el ciclo. Se asume que todas las fases del ciclo son procesos reversibles.
. En la fase “2” se expande isotérmicamente (a temperatura constante), hasta recuperar la presión inicial P0 en el estado “C”. A continuación realiza otro proceso isócoro “3” hasta el estado “D” para, finalmente, realizar un nuevo proceso isotermo “4” que termina en el estado “A”, completando el ciclo. Se asume que todas las fases del ciclo son procesos reversibles.
- Obtenga los valores de presión, volumen y temperatura en los estados “B”, “C” y “D”, en función de los correspondientes al estado “A”.
- En cada fase del proceso cíclico, calcule las cantidades de energía transferida en forma de calor y de trabajo. Determine también la variación de energía interna en cada fase.
- Calcule el trabajo neto realizado por el sistema en el ciclo ( | Wout | − Win), y las cantidades de calor absorbido (Qin), y cedido (Qout).
- Calcule el rendimiento de esta máquina térmica, definido como el cociente entre el trabajo neto realizado y el calor absorbido en un ciclo. Compárelo con el rendimiento de una máquina térmica de Carnot que trabajase entre los mismos focos térmicos que la analizada.
2 Solución
2.1 Valores de las variables de estado en los estados de equilibrio
Conocidos los valores de presión volumen y temperatura en el estado de equilibrio inicial “A”,
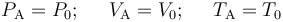
determinamos los valores de estas variables en los otros estados de equilibrio a partir de la descripción del proceso y exigiendo que, en cada uno de esos estados de equilibrio, dichos valores deben verificar la ecuación de estado,
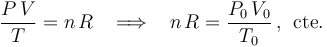
en todos los estados de equilibrio, pues la cantidad de gas (el número 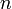 de moles) permanece constante durante todo el proceso, y
de moles) permanece constante durante todo el proceso, y 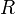 es la constante de los gases ideales, cuyo valor en el Sistema Internacional de unidades es
es la constante de los gases ideales, cuyo valor en el Sistema Internacional de unidades es 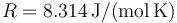 .
.
El proceso que lleva al sistema del estado “A” al “B” se realiza a volumen constante (isócoro), hasta que la temperatura alcanza un determinado valor conocido; por tanto...
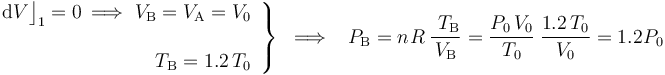
El paso del estado “B” al “C” se realiza manteniéndose constante la temperatura (isotermo), hasta que se recupera la presión del estado inicial “A”:
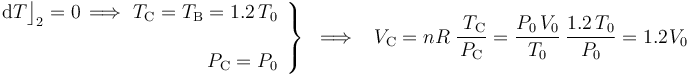
El proceso de “C” a “D” es nuevamente un proceso isócoro en el cuál se mantendrá constante el volumen; es decir, a dichos estados le corresonponde el mismo volumen. Por otra parte, la última fase del proceso cíclico (del estado “D” al “A”) vuelve a ser isoterma; por tanto, ambos estados de equilibrio va a tener igual valor de temperatura. En consecuencia,
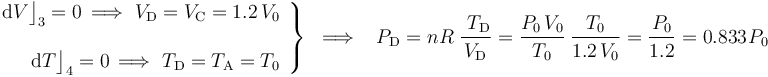
2.2 Energías transferidas a lo largo del proceso
En este apartado se procederá a calcular las cantidades de energía transferida entre el sistema (gas ideal) y el entorno, en forma de calor (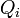 ), y de trabajo (
), y de trabajo (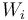 ), en cada una de las cuatro fases(
), en cada una de las cuatro fases( ) del proceso cíclico reversible realizado por el gas.
) del proceso cíclico reversible realizado por el gas.
- Proceso isócoro “1”
Al tratarse de un proceso reversible a volumen constante, la cantidad de energía transferida en forma de trabajo será nula:
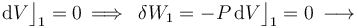
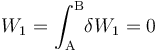
En cuanto al calor transferido, dependerá de la capacidad calorífica a volumen constante 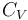 del sistema, consistenete en
del sistema, consistenete en 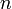 moles de un gas monoátomico:
moles de un gas monoátomico:
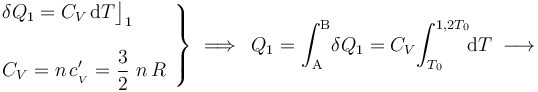
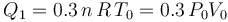
La aplicación del Primer Principio de la Termodinámica determina que la variación de energía interna será igual a la energía transferida en forma de calor:
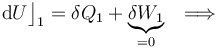
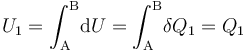
- Proceso isotermo “2”
Como es bien sabido, en un sistema formado por un gas en condiciones de gas ideal, la energía interna del sistema es sólo función de la temperatura. En consecuencia, la variación de aquella magnitud dependerá exclusivamente de la variación que experimente esta variable de estado:
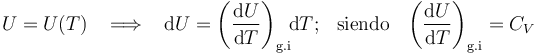
Y como la fase “2” del proceso cíclico bajo estudio se realiza a temperatura constante, la energía interna del sistema también permacenerá invariable. Por tanto, en virtud del Primer Principio de la Termodinámica se tendrá que en este proceso reversible las cantidades de energía transferida en forma de calor y de trabajo serán opuestas:
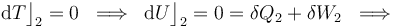
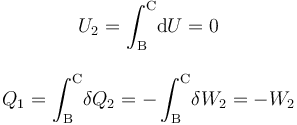
Luego, basta con calcular sólo una de estas cantidades de energía transferida. Como el proceso se realiza a temperatura constante, no es posible determinar el calor transferido a partir de los cambios de esta variable de estado. Sin embargo, al tratarse de un gas ideal que realiza un proceso reversible, consistente en una secuencia de estados de equilibrio en los que se verifica la ecuación de estado, se tendrá:
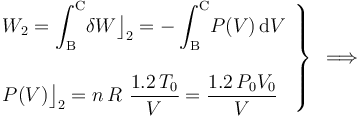
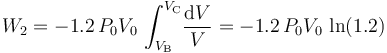
- Proceso isócoro “3”
La fase “3” vuelve a ser un proceso isócoro, en el cual se tendrán resultados anólogos a los obtenidos en “1”, aunque determinados por los valores de las variables de estado en los estados “C” y “D”. Es decir, no habrá energía transferida en forma de trabajo; la tranferida en forma de calor está determinada por el cambio de temperatura a volumen constante entre aquellos estados, y coincidirá con la variación de energía interna del sistema: