Los gases ideales (GIE)
De Laplace
1 Ecuación general
Combinando la ley de Charles con la de Boyle obtenemos, para un sistema cerrado en el que la masa de gas permanece constante,
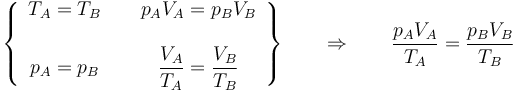
o, equivalentemente,
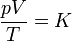
siendo K una constante específica para cada muestra de gas y que no depende ni de la presión, ni del volumen, ni de la temperatura. Puesto que el primer miembro es una cantidad extensiva (el volumen es proporcional a la masa), el segundo miembro también debe serlo, por lo que puede escribirse en la forma
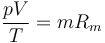
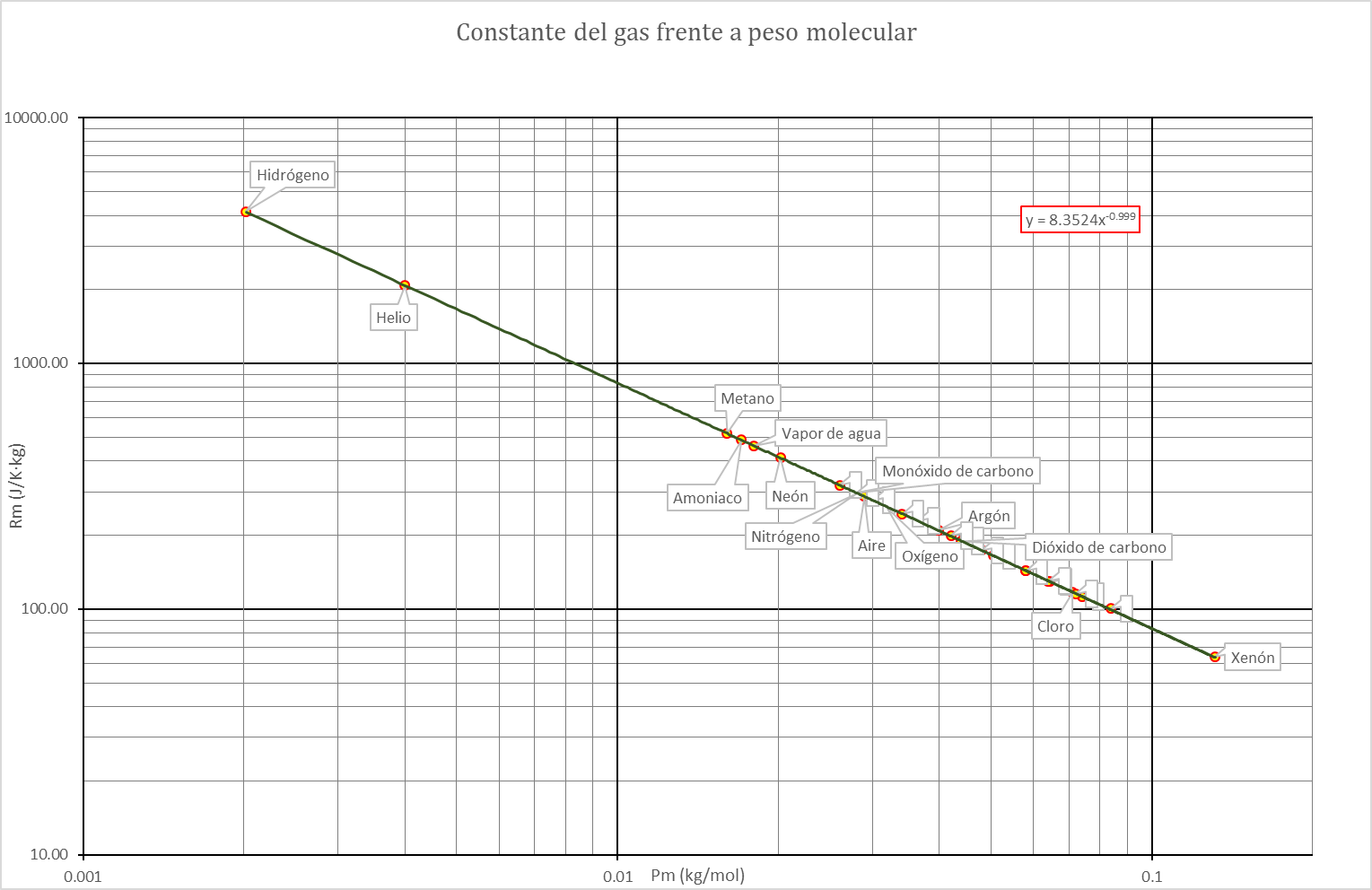
siendo Rm una constante diferente para cada gas (constante del gas).
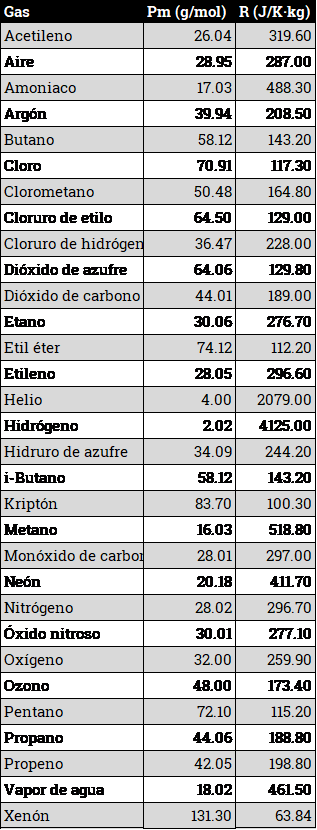
Una tabla de valores, tomada de Engineering toolbox y de Pipe Flow calculations sería la siguiente:
1.1 Gases puros
Si a partir de la tabla anterior se representa la constante de cada gas en función del peso molecular, podemos ver, mediante una escala logarítmica, que esa constante es, muy aproximadamente, inversamente proporcional al peso molecular
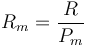
Para un gas puro, constituido por un solo tipo de moléculas, la ley de los gases ideales puede escribirse en función del número de moles

siendo Pm el peso molecular. Se encuentra experimentalmente que el producto
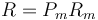
es prácticamente independiente del gas de que se trate. Por ello, a la constante R se la denomina constante universal de los gases ideales. De esta forma, queda la ecuación general
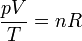
El valor de R en el SI es
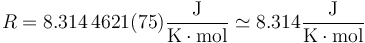
Esta ecuación de estado suele escribirse en la forma
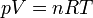
1.2 Mezclas ideales de gases ideales. El aire seco
Las mezclas de gases, como el aire seco (sin vapor de agua), no son sustancias puras, sino que combinan diferentes tipos de moléculas. Por ello, aunque cumplen la ley de los gases ideales
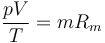
con
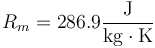
para el aire seco, no es trivial pasar esta expresión a número de moles, ya que ¿qué es un mol de aire? No podemos multiplicar la constante por el peso molecular del aire, pues no está definido en principio (¿es el del nitrógeno? ¿el del oxígeno? ¿cómo se combinan?). De hecho, podemos emplearla para definir un peso molecular efectivo
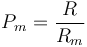
que nos da, para el aire seco,
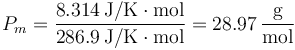
Ahora bien, podemos llegar al peso molecular efectivo de otra forma.
En una mezcla ideal de gases ideales, no solo se comporta idealmente cada gas por separado, sino que no interactúan entre sí. En ese caso, cada molécula se mueve independientemente y los choques que puedan tener con las paredes no dependen del resto de sustancias. Por tanto la presión resultante es la suma de las presiones parciales, que son las que producirían los distintos gases si estuvieran solos en el recipiente

Como cada gas es ideal y la temperatura de cada uno y el volumen que ocupa es el mismo para todos
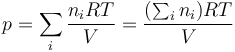
Comparando con la ecuación de los gases ideales para una sustancia pura, podemos definir el número de moles de aire como
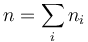
Por otro lado, la masa total del aire es la suma de las de los gases constituyentes
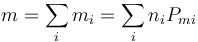
lo que nos permite definir el peso molecular del aire como
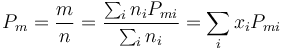
siendo xi la fracción molar del gas i
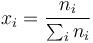
Aplicando esto al caso del aire seco, que tiene una fracción molar de 78.1% de N2, 20.9% de O2 y 1.0% de Ar (más otros gases en fracciones menores) resulta un peso molecular efectivo
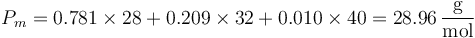
de acuerdo con el otro cálculo.





