Mezcla de agua y vapor de agua
De Laplace
Contenido |
1 Enunciado
Se tiene un recipiente cilíndrico de paredes adiabáticas y con pistón móvil también adiabático, inmerso en un ambiente a 300 K y 101.3 kPa de presión. Dentro del recipiente se ponen en contacto 1 kg de agua a 100 °C (“subsistema 1”) con 1 m³ de vapor de agua a 200 ° (“subsistema 2”).
El agua puede considerarse un líquido incompresible de densidad 958.4 kg/m³.
El vapor de agua puede suponerse un gas ideal tal que a 100 °C y 101.3 kPa tiene una densidad de masa de 0.598 kg/m\tss{3}. En todo el rango 100 °C − 200 °C su calor específico promedio vale  .
.
La entalpía específica de vaporización a 100 °C y 101.3 kPa vale 2257 kJ/kg.
- Calcule, para una vez que se ha alcanzado el equilibrio térmico, qué cantidad de agua y de vapor de agua tenemos en el sistema. ¿Cuál es la proporción de la masa de vapor de agua respecto a la masa total?
- Calcule la variación de energía interna y de entalpía del sistema completo y de cada subsistema en este proceso, así como el trabajo realizado sobre el sistema completo y sobre cada subsistema.
2 Estado final
Puesto que el sistema completo está aislado térmicamente, toda la transferencia de calor será interna. Habrá una cierta cantidad de calor que pase del vapor de agua (que está más caliente) al agua saturada (que está más fría).
Por ser el pistón móvil, la presión del sistema permanece constante en todo momento, ya que el cambio de volumen hace subir o bajar el pistón, pero siempre en equilibrio mecánico con la presión exterior.
En el estado final, el vapor de agua habrá bajado a 100°C, mientras que parte del agua se habrá evaporado (puesto que ya está saturada no se calienta más, sino que todo el calor que le llega la hace pasar a la fase gaseosa).
Puesto que la evaporación del agua requiere mucha energía, no se va a evaporar toda el agua líquida.
- Masa de vapor de agua
- El primer paso es conocer cuanta masa de agua en forma de vapor tenemos inicialmente, ya que la cantidad máxima de calor que podemos extraer de ella es
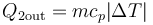
- Para hallar la masa tenemos la densidad y el volumen, pero a distintas temperaturas, por lo que debemos calcular el volumen que ocupa el vapor de agua a 100°C. Por ser un gas ideal a presión constante se cumple la ley de Charles
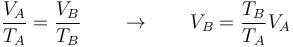
- Sustituimos los valores numéricos

- Por tanto, al enfriarse, el vapor del agua reduce su volumen. Ahora sí podemos calcular la masa de vapor que forma el subsistema 2
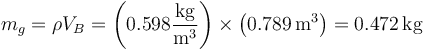
- Calor que pierde el vapor
- Una vez que tenemos la masa, podemos hallar la cantidad de calor que extraemos del subsistema 2 al bajar su temperatura 100 °C (o 100 K)
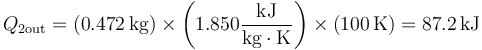
- Vemos que la cantidad de calor es pequeña comparada con la entalpía de vaporización del agua.
- Cantidad de agua que se evapora
- La cantidad de agua líquida que pasamos a la fase gaseosa la sacamos de
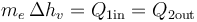
- lo que nos da
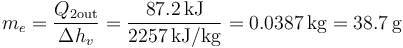
- Masa final de agua y de vapor de agua
- Por tanto, en el estado final nos queda una cantidad de agua líquida

- mientras que la masa total de agua en forma de vapor es

- la temperatura de ambas fases es de 100°C pues están en equilibrio térmico.
La proporción de vapor de agua respecto a la masa total es
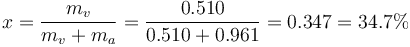
3 Balance energético
3.1 Entalpía
Puesto que el proceso es a presión constante, el calor transferido es igual a la variación de la entalpía:
- Para el sistema completo
- Puesto que el conjunto está asilado por paredes adiabáticas
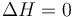
- Para el subsistema 1
- La variación corresponde a la cantidad de calor que absorbe para evaporarse
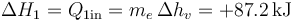
- Para el subsistema 2
- La entalpía disminuye al salir calor y enfriarse el vapor
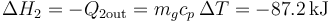
3.2 Trabajo
Sobre las distintas partes del sistema se realiza trabajo porque su volumen cambia. Todo el trabajo se realiza a presión constante, por lo que en todos los casos sigue la ley
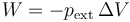
- Para el subsistema 2
- El volumen inicial es de 1 m³. El final 0.789 m³. El trabajo sobre este subsistema vale

- Para el subsistema 1
- El cálculo es similar, pero hay que tener en cuenta que está formado en parte por líquido y en parte por vapor. El volumen inicial es

- y el final

- siendo el trabajo

- Para el sistema completo
- El trabajo total es la suma de los dos anteriores

3.3 Energía interna
Una vez que tenemos el calor y el trabajo, la variación de la energía interna es inmediata.
- Subsistema 1
- Sumando las dos contribuciones

- Subsistema 2
- Análogamente
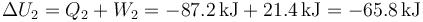
- Sistema completo
- Es la suma de las dos anteriores o, como el calor total es nulo, igual al trabajo total






