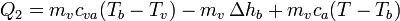Mezcla de hielo y vapor de agua
De Laplace
Revisión a fecha de 10:31 27 feb 2012; Antonio (Discusión | contribuciones)
1 Enunciado
En un recipiente a presión constante de 101.3 kPa, se ponen en contacto 1.0 m³ de vapor de agua a 115 °C con 500 g de hielo a −10 °C. Determine la temperatura final del sistema.
2 Solución
Al poner en contacto las dos fases se producirá un flujo de calor desde el vapor al hielo. Uno se irá enfriando a medida que el otro se calienta, quedando el sistema en un estado final en que ambos subsistemas tienen la misma temperatura.
Suponemos de entrada que el estado final será un punto intermedio en el que las dos fases se encuentran en el estado de agua líquida.
Para convertir el hielo en agua a una temperatura T es necesario proporcionar un calor
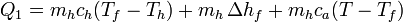
donde:
- el primer término, mhch(Tf − Th), representa el calor necesario para llevar el hielo desde su temperatura inicial, Th a la temperatura de fusión Tf-
- el segundo término,
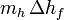 , es el calor preciso para fundir el hielo
, es el calor preciso para fundir el hielo
- el tercer término, mhca(T − Tf), es el calor que hace falta para elevar la temperatura del agua desde el punto de fusión hasta la temperatura final.
De la misma manera, para el enfriamiento del vapor escribimos