Equilibrio mecánico y térmico. Presión y temperatura (GIE)
De Laplace
Contenido |
1 Sistemas en equilibrio mecánico
Para enunciar el principio cero de la termodinámica, referido al equilibrio térmico entre sistemas, conviene establecer en primer lugar una analogía con el equilibrio mecánico.
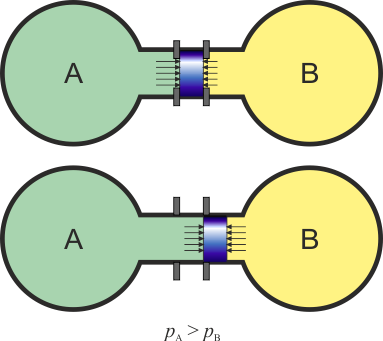
Consideremos dos tanques de gas conteniendo volúmenes de aire a presiones que pueden ser iguales o diferentes. Estos dos tanques se encuentran unidos por un cilindro, en el interior del cual se encuentra un pistón que puede deslizarse a lo largo del tubo. Inicialmente el pistón está sujeto externamente con una llave. En un momento dado se libera el pistón.
- Si, al liberar el pistón, este comienza a desplazarse, llegamos a la conclusión de que las presiones de los gases a ambos lados son diferentes. No sabemos cuánto valen ni las presiones ni su diferencia, sólo que no son iguales.
- Si, por el contrario, al liberar el pistón, este se queda en el mismo sitio, llegamos a la conclusión de que la presión a ambos lados es la misma, aunque no sabemos cuánto vale. En ese caso los dos tanque están en equilibrio mecánico.
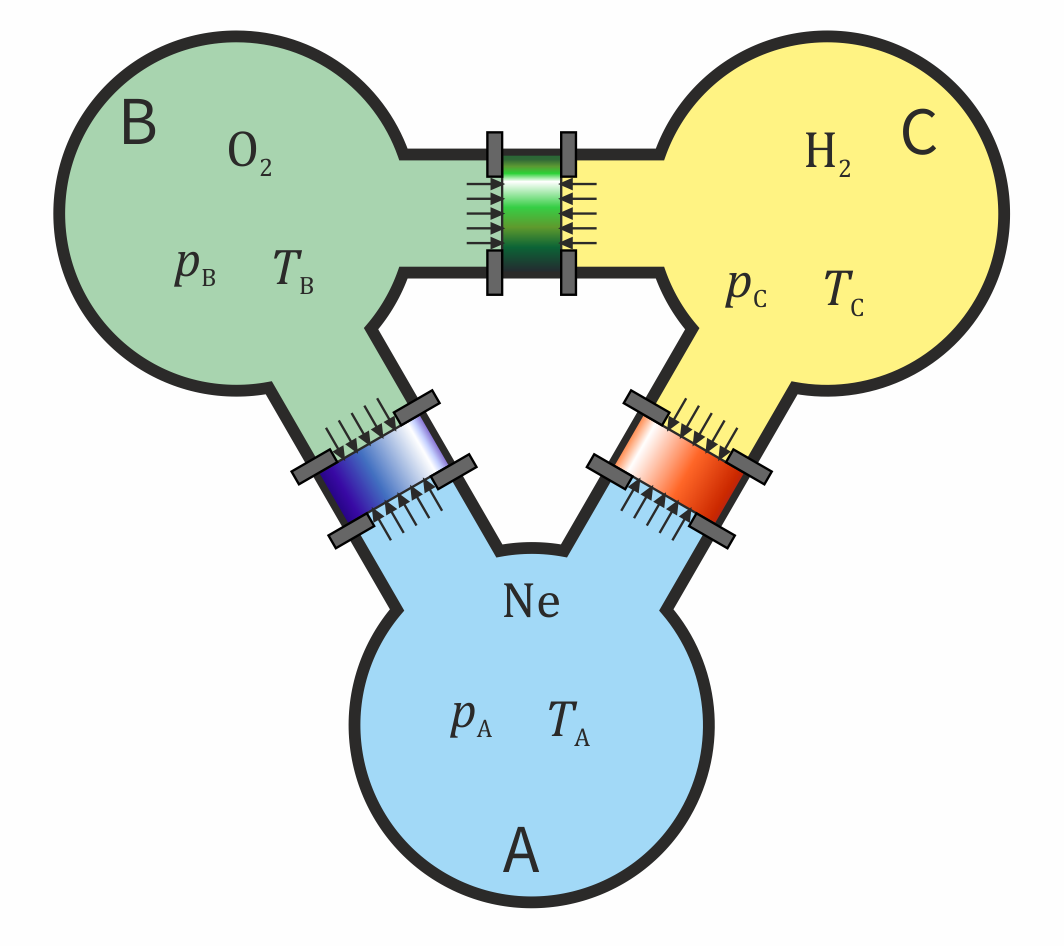
Consideremos ahora un caso en el que tenemos un sistema de tres tanques, A, B y C, que están conectados dos a dos por sendos tubos cilíndricos. Supongamos que liberamos el émbolo del tubo que conecta a A y a B y se queda en el sitio en que estaba. Ahora liberamos el que separa a A y a C y resulta que también permanece en el sitio. Sabemos lo que ocurrirá si liberamos el situado entre B y C: tampoco se moverá. La presión en B será la misma que en A y la de C también es la misma que la de A. Por tanto, las presiones de B y C son iguales y se encuentran en equilibrio mecánico. La liberación del pistón no supone cambio alguno, pues las fuerzas a ambos lados son de la misma magnitud.
Diremos entonces que "dos volúmenes de gas en equilibrio mecánico con un tercero, están en equilibrio mecánico entre sí". Y podremos afirmar que los tres volumenes tienen una propiedad en común, que es la presión.
No todos los equilibrios cumplen esta propiedad transitiva. Supongamos que el tanque A contiene neón, el B contiene oxígeno y el C contiene hidrógeno. Si se abre el tubo que une a A y a B no se produce reacción química entre el oxígeno y el neón (que es un gas noble), los dos gases están en equilibrio químico. Si ahora abrimos el tubo que A y a C tampoco se produce reacción. El hidrógeno también se encuentra en equilibrio químico con el neón. Pero si ahora abrimos el tubo que conecta a B y a C, poniendo en contacto el oxígeno con el hidrógeno, sí que reaccionarán de manera bastante explosiva. El oxígeno y el hidrógeno no se encuentran en equilibrio químico.
2 Principio cero de la termodinámica
2.1 Equilibrio térmico
El estado de un sistema puede describirse por una serie de propiedades. A partir de la experiencia, consideramos que una de estas propiedades es la temperatura del sistema. Aun no hemos dado una definición precisa del término, pero entendemos que un sistema puede encontrarse a diferentes temperaturas. Así, a la presión atmosférica, un recipiente con agua tiene mayor temperatura que si contiene un bloque de hielo. De la experiencia tomamos conceptos como “caliente”, “templado” o “frío”. Se trata de definir de forma precisa el concepto de temperatura y construir una escala que permita medirla.
Cuando se ponen en contacto dos sistemas a diferente temperatura, “algo” pasa de uno de los sistemas al otro. Ese “algo” es el calor (que aún no hemos definido de forma precisa), pero que se deduce que se ha transferido, porque se manifiesta en el cambio de estado del sistema. Si ponemos un bloque de hielo en un baño de agua caliente sabemos que el hielo se funde y el agua se enfría, cambiando las propiedades de cada una de los dos subsistemas.
Por ejemplo, podemos poner en contacto un tubo lleno de mercurio con una tanque de gas. El estado del mercurio se define por la longitud que alcanza dentro del tubo, mientras que el del gas por la presión que mide un manómetro. Entendemos que cuanto mayor sea la temperatura. mayor en la altura de la columna de mercurio y mayor la presión del gas
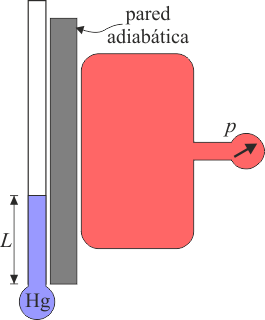
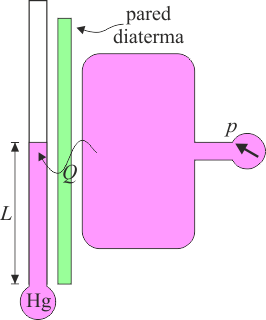
Un sistema está aislado térmicamente cuando, sea lo que sea lo que se pone en contacto con él, el estado del sistema no cambia. Esto se consigue rodeándolo de una pared aislante, como la de un termo. Una pared de este tipo se denomina una frontera adiabática.
Normalmente, al poner en contacto dos sistemas, el calor sí puede fluir de un sistema al otro. En este caso, se dice que la frontera es diaterma o diatérmica.
Cuando ponemos en contacto dos sistemas mediante una pared diaterma y los sistemas no modifican su estado, pudiendo hacerlo, decimos que los dos sistemas se encuentran en equilibrio térmico. Es el análogo de que no se mueva el émbolo al conectar dos bombonas de gas.
2.2 Principio cero de la termodinámica
Estamos en condiciones de enunciar la primera de las leyes de la termodinámica. Supongamos que tenemos tres sistemas A, B, y C, como pueden ser los tres tanques de gas de la figura anterior. Se conectan los sistemas A y B a través de una pared diaterma y se comprueba que se encuentran en equilibrio térmico. Se conectan entonces el A y el C y se verifica que también se encuentran en equilibrio térmico. En ese caso, todas las experiencias muestran que si se conectan térmicamente los sistemas B y C tampoco cambiará su estado, esto es:
- Principio cero de la termodinámica: Dos sistemas en equilibrio térmico con un tercero, se encuentran en equilibrio térmico entre sí.
Esta es una ley empírica que carece de demostración. Podemos considerarla razonable, por analogía con el caso del equilibrio mecánico, pero podría no cumplirse (como ocurre con el equilibrio químico, en el que no se cumple la propiedad transitiva).
Su extraño nombre se debe a que fue formulado como ley independiente en 1935 por Fowler, mucho después de que fueran enunciados el primer y el segundo principio de la termodinámica, pese a que lógicamente debe establecerse como condición previa.
3 Medida de la temperatura
3.1 Termómetros
El principio cero de la termodinámica nos permite definir la temperatura como “lo que miden los termómetros”. Esta definición parece demasiado simple y un tanto circular, pero es efectiva. La clave es que el principio cero nos permite construir un termómetro y una escala de temperatura. La forma de hacerlo es caracterizando cada valor de la temperatura por el valor correspondiente de otra propiedad del sistema (lo que se denomina una propiedad termométrica).
Supongamos que tenemos un sistema T consistente, por ejemplo, en un fino tubo de vidrio en cuyo interior existe una columna de mercurio. La altura de esta columna puede variar según el mercurio se dilate o contraiga. Si ahora colocamos este sistema T en contacto con un sistema A (un baño de agua, por ejemplo) el mercurio llega a una cierta altura; acto seguido lo colocamos en contacto con otro sistema B y el mercurio llega a la misma altura que antes, llegamos a la conclusión de que A y B se encuentran en equilibrio térmico y les podemos asociar el mismo valor de la temperatura, siendo este valor, con las unidades adecuadas, la altura de la columna de mercurio.
La forma de construir un termómetro es entonces elegir un sistema caracterizado por una sola propiedad (la altura del mercurio, la presión de un gas, la dilatación de un metal, la diferencia de potencial entre dos electrodos, por ejemplo), asignar un valor de 0%deg; a un valor determinado de esta propiedad y definir un “tamaño” del grado a partir de la variación de la propiedad entre dos puntos.
3.2 Escalas de temperatura
Para definir una escala de temperaturas hacen falta entonces un mínimo de dos puntos. Según los que se elijan se obtiene una escala u otra.
- Escala Celsius
- Se toma como 0 °C (grados Celsius, también llamado grados centígrados) la temperatura de congelación del hielo a 1 atm de presión (101325 Pa) y como 100°C la de ebullición del agua a la misma presión.
- Escala Fahrenheit
- Definida originalmente como una que iba con el 0°F a la temperatura más baja a la que se podía conseguir agua líquida con sal y con 96°F a la temperatura “de un hombre sano”. Para evitar imprecisiones, hoy se define como que la temperatura de congelación del agua a 1 atm es 32°F y la de ebullición 212°F. Esto da la relación
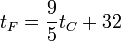
- Escala absoluta
- Se establece como una escala que tiene su 0 K (kelvins, sin el “grado”) en el cero absoluto y tiene un valor de 273.16 K en el punto triple del agua (en el cual el agua líquida se encuentra en equilibrio térmico con el hielo y con el vapor de agua). En la práctica esto implica que los kelvins tienen el mismo tamaño que los grados Celsius y que la temperatura de congelación del agua a 1 atm es de 273.15 K, de forma que
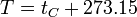
- Una consecuencia importante de que los kelvins tengan el mismo tamaño que los grados Celsius es que un incremento de temperaturas tiene el mismo valor en las dos escalas
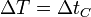
Aparte de estas escalas existen otras como la Rankine (equivalente a la absoluta, pero con grados del tamaño de los grados Fahrenheit).
3.3 Temperatura absoluta
El problema que tiene la definición de temperatura basadas en las medidas de un termómetro concreto es que las escalas de los diferentes aparatos coincidirán en los dos puntos de referencia (a 0°C y 100°C en el caso de los grados Celsius), pero no tienen por qué coincidir en el resto de las temperaturas. Para una temperatura intermedia en la que el mercurio marca 50°C, quizás el termómetro de gas marca 50.01°C. Por ello, interesa definir una escala de temperaturas absoluta, que sea independiente del aparato de medida. Para hacer esto de forma rigurosa se necesita el segundo principio de la termodinámica, si bien se puede construir una escala con un termómetro de gas que se aproxima mucho a la absoluta.
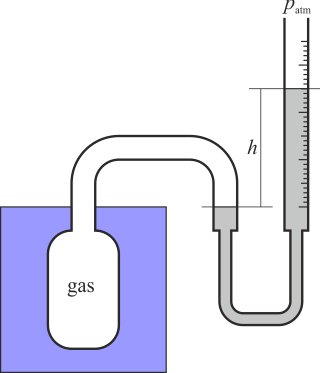
Para ello se emplea el termómetro de gas a volumen constante. Éste consiste esencialmente en una vasija que contiene un gas a baja presión. Esta vasija está conectada a un tubo flexible que contiene mercurio. El tubo flexible está unido a uno rígido abierto al exterior (a la presión atmosférica).La vasija se pone en contacto con el líquido cuya temperatura se quiere medir. Si al variar la temperatura del gas éste se expande, variando su volumen, para mantener constante el volumen se eleva o baja el tubo rígido, de forma que aumenta la presión sobre el gas, comprimiéndolo hasta que vuelve a ocupar el volumen original. Cuando se ha alcanzado la posición original, semide el desnivel entre dos tubos. Esto nos dice que la presión del gas es
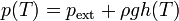
(h puede ser negativa, si el gas está a una presión menor que la atmosférica. De esta forma podemos medir la temperatura a partir de la presión del gas, que a su vez se calcula mediante la lectura del nivel del mercurio. La temperatura del gas en grados Celsius será
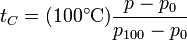
Lo que tiene de especial este termómetro es que permite obtener una escala absoluta. Supongamos que construimos cuatro termómetros de gas a volumen constante, cada uno con un gas diferente (hidrógeno, nitrógeno, oxígeno y neón, por ejemplo). Para una temperatura dada, por ejemplo la de fusión del azufre, cada uno de los termómetros dará una lectura ligeramente diferente. Pero si se va reduciendo la densidad del gas de la vasija, los valores medidos se van acercando y en el límite tienden al mismo valor, independientemente del gas concreto que se emplee. De esta forma podemos construir una escala de temperaturas absoluta como la que tendría un termómetro de gas a volumen constante en el límite en el que la densidad del gas se anula. Naturalmente, no se pueden anular del todo porque nos quedaríamos sin termómetro, pero se puede extrapolar y calcular cuánto mediría este termómetro ideal.
El resultado es que la presión del gas varía linealmente con la temperatura
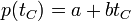
Podemos preguntarnos, para esta escala independiente del gas, a qué temperatura se anularía la presión del gas interior. El resultado es, experimentalmente
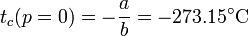
para todos los gases empleados. Construimos entonces la temperatura absoluta
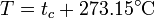
y la presión del gas es simplemente proporcional a la temperatura absoluta
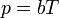
siendo b una constante que depende de la densidad del gas y otras constantes.