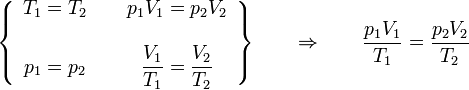Los gases ideales (GIE)
De Laplace
Contenido |
1 Introducción
2 Presión y temperatura de un gas
3 Ecuación de estado
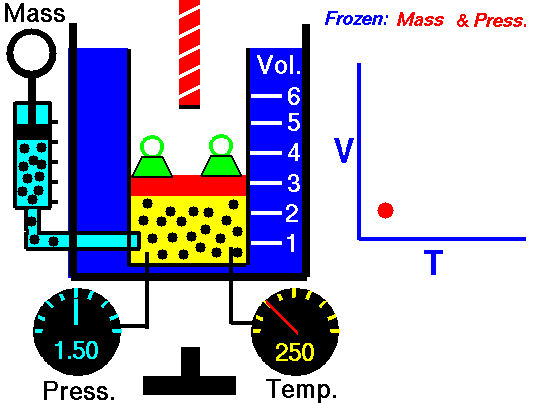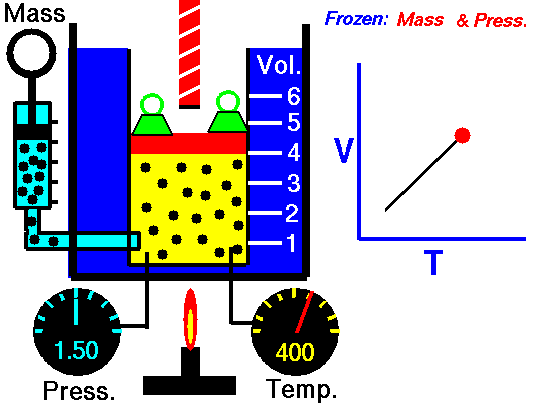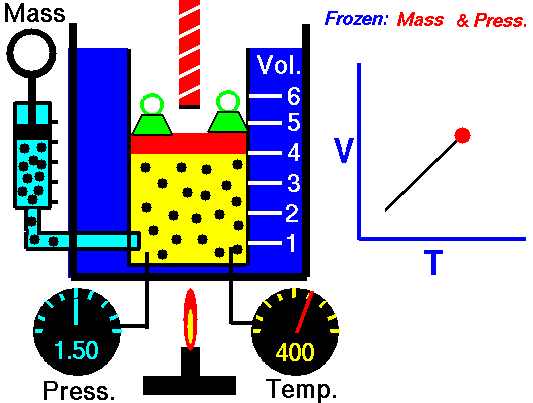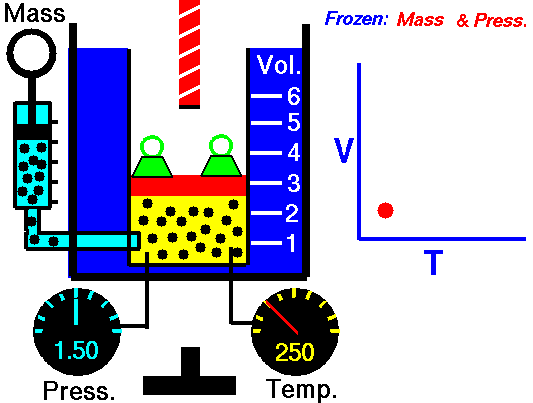
3.1 Ley de Boyle
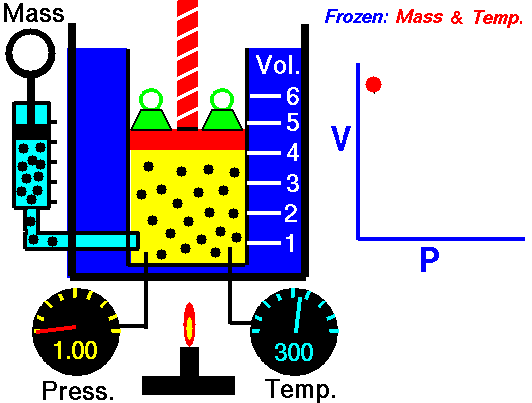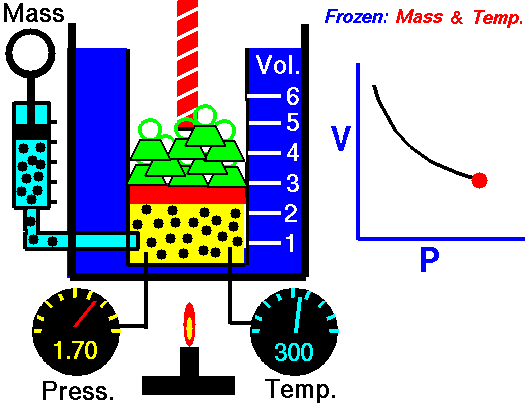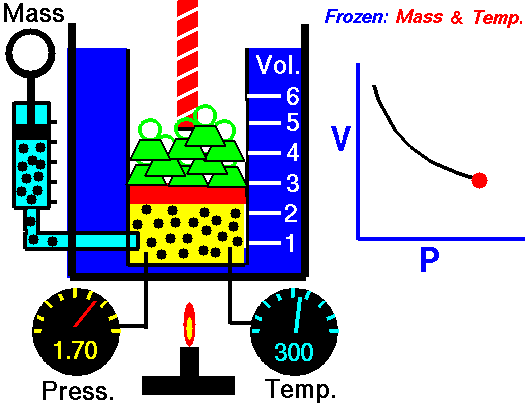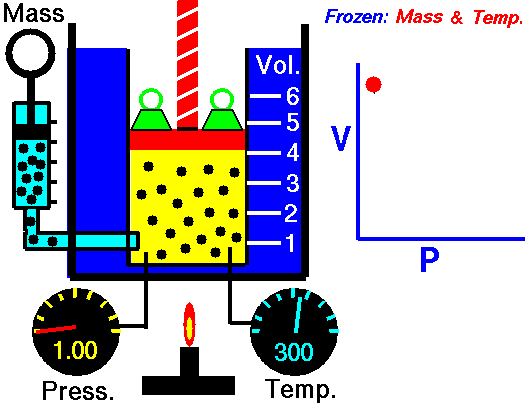
La ley de Boyle (también conocida como ley de Boyle y Mariotte), nos dice que si en un gas ideal se mantiene la temperatura constante, la presión del gas es inversamente proporcional al volumen que ocupa, lo que se expresa
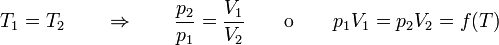
Si aquí introducimos magnitudes específicas, dividiendo por la masa de gas, nos queda
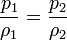
o, equivalentemente, que la densidad de un gas ideal es proporcional a su presión, a temperatura constante

con F(T) una cierta función de la temperatura y proporcional a la masa de gas.
3.2 Ley de Charles
La ley de Charles (también llamada de Gay-Lussac, de Charles y Gay-Lussac, o de los volúmenes) afirma que en un gas ideal a presión constante, el volumen que ocupa el gas varía linealmente con la temperatura que tiene

o equivalentemente, que la temperatura de un gas ideal varía linealmente con el volumen que ocupa
Experimentalmente se encuentra que la la ordenada t0, que representaría la temperatura a la cual el gas ideal ocuparía un volumen nulo (aunque ningún gas se puede llevar hasta esa temperatura), es independiente de la presión del gas siempre que sea baja y vale aproximadamente 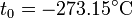 . Definiendo entonces la temperatura absoluta del gas como
. Definiendo entonces la temperatura absoluta del gas como

la ley de Charles se escribe
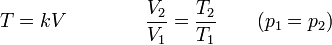
3.3 Ecuación general
Combinando la ley de Charles con la de Boyle obtenemos