Compresión lineal
De Laplace
Contenido |
1 Enunciado
Se tiene un volumen V0 de un gas ideal diatómico a una presión p0 y una temperatura T0 encerrado en un recipiente con un pistón móvil. Este gas se comprime reversiblemente según la ley
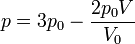
reduciéndose el volumen hasta V0 / 2.
- Trace la gráfica del proceso en un diagrama PV.
- Calcule la temperatura final del proceso.
- Calcule el trabajo neto realizado sobre el gas, la variación de su energía interna y el calor que entra en el gas durante el proceso.
- ¿Para qué volumen durante el proceso la temperatura es máxima? Halle el valor de esta temperatura máxima.
- Separando el proceso en dos: uno hasta que alcanza la temperatura máxima y otro de ahí hasta el final, halle W, ΔU y Q en cada uno de los dos subprocesos.
2 Representación gráfica
Dado que la presión depende del volumen en la forma
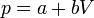
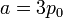

es claro que la gráfica del proceso es un segmento rectilíneo. El punto inicial del segmento es (p0,V0) y el punto final corresponde a V = V0 / 2 y a la presión
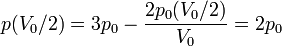
Por tanto el volumen final es la mitad del inicial, mientras que la presión es el doble.
3 Temperatura final
Obtenemos la temperatura final a partir de la ecuación de los gases ideales. Inicialmente tenemos
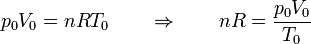
En el estado final
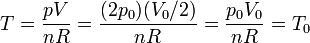
Por tanto, la temperatura final es igual a la inicial.
4 Trabajo, energía y calor
4.1 Trabajo
El trabajo realizado sobre el gas en un proceso reversible es igual a la integral
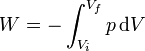
En nuestro caso
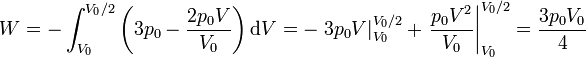
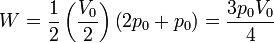
4.2 Energía interna
Por tratarse de un gas ideal, la variación en la energía interna solo depende de la temperatura inicial y la final
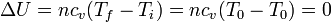
Puesto que la temperatura inicial y la final son la misma, no hay variación en la energía interna del gas.
4.3 Calor
Una vez que tenemos el trabajo y la variación de la energía interna, hallamos el calor empleando el primer principio de la termodinámica
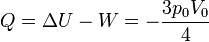
En este proceso se realiza trabajo, pero puesto que la temperatura del sistema es la misma al principio y al final, ese trabajo sale del sistema en forma de calor. Este proceso, no obstante, no es isotermo, ya que la temperatura del sistema cambia en los estados intermedios.





