Compresión isoterma de un gas
De Laplace
1 Enunciado
Un cilindro vertical de 10.0 cm de diámetro contiene hidrógeno a 25°C y 100 kPa de presión, que también es la temperatura y presión exterior. La tapa del cilindro puede deslizarse sin rozamiento e inicialmente se encuentra a 10.0 cm de altura. Se coloca sobre la tapa una pesa de 2.0 kg. Halle la altura de la tapa una vez que se alcanza de nuevo el equilibrio térmico con el exterior. ¿A qué temperatura habrá que calentar el gas para que la tapa vuelva a su posición inicial, con el peso todavía encima?
2 Compresión isoterma
Cuando se coloca la pesa sobre el émbolo, aumenta la presión sobre el gas, siendo la nueva presión ejercida

Al ser esta presión superior a la interior, aparece una fuerza sobre el pistón y este desciende. Al hacerlo comprime el gas, aumentando su presión. En un proceso real, la presión interior llega a superar a la exterior, causando una fuerza hacia arriba y un “rebote” del émbolo. Tras una serie de oscilaciones, el pistón se detiene en una posición de equilibrio, en la que la presión del gas iguala a la exterior. Puesto que en el estado final la temperatura final iguala a la inicial, podemos aplicar la ley de Boyle
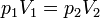
siendo
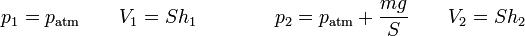
lo que nos da
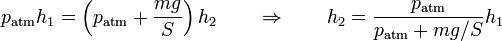
Sustituyendo los valores numéricos
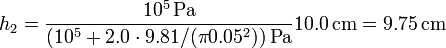
Vemos que la bajada del pistón es muy pequeña, ya que el incremento de la presión supone solo
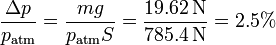
Esto muestra lo grande que es realmente la presión atmosférica, ya que la fuerza que ejerce equivale la que crearía una pesa de unos 80 kg, por lo que una de solo 2 kg no hace mucha mella.
3 Calentamiento isóbaro
En el segundo proceso la presión permanece constante, mientras que el volumen aumenta con la temperatura. En este caso la ley de los gases ideales se reduce a la ley de Charles
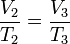
donde

lo que resulta en
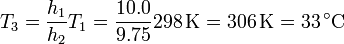
El incremento de temperatura necesario es entonces igual a 8°C





