Ciclo Brayton
De Laplace
Contenido |
1 Enunciado
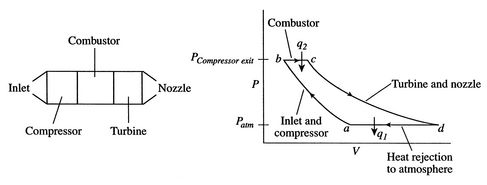
Un ciclo Brayton (o Joule) ideal modela el comportamiento de una turbina, como las empleadas en las aeronaves. Este ciclo está formado por cuatro pasos reversibles, según se indica en la figura. Pruebe que el rendimiento de este ciclo viene dado por la expresión
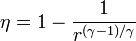
siendo r = p2 / p1 la relación de presión. El método para obtener este resultado es análogo al empleado para el Ciclo Otto.
2 Descripción del ciclo
El ciclo Brayton describe el comportamiento ideal de un motor de turbina de gas, como los utilizados en las aeronaves. Las etapas del proceso son las siguientes:- Entrada
- El aire frío ya presión atmosférica entra por la boca de la turbina
- Compresor
- El aire es comprimido y dirigido hacia la cámara de combustión mediante un compresor (movido por la turbina). Puesto que esta fase es muy rápida, se modela mediante una compresión adiabática A→B.
- Cámara de combustión
- En la cámara, el aire es calentado por la combustión del queroseno. Puesto que la cámara está abierta el aire puede expandirse, por lo que el calentamiento se modela como un proceso isóbaro B→C.
- Turbina
- El aire caliente pasa por la turbina, a la cual mueve. En este paso el aire se expande y se enfría rápidamente, lo que se describe mediante una expansión adiabática C →D.
- Escape
- Por último, el aire enfriado (pero a una temperatura mayor que la inicial) sale al exterior. Técnicamente, este es un ciclo abierto ya que el aire que escapa no es el mismo que entra por la boca de la turbina, pero dado que sí entra en la misma cantidad y a la misma presión, se hace la aproximación de suponer una recirculación. En este modelo el aire de salida simplemente cede calor al ambiente y vuelve a entrar por la boca ya frío. En el diagrama PV esto corresponde a un enfriamiento a presión constante D→A.
3 Eficiencia en función del calor
3.1 Intercambio de calor
De los cuatro procesos que forman el ciclo cerrado, no se intercambia calor en los procesos adiabáticos A→B y C→D, por definición. Sí se intercambia en los dos procesos isóbaros.
- En la combustión B→C, una cierta cantidad de calor Qc (procedente de la energía interna del combustible) se transfiere al aire. Dado que el proceso sucede a presión constante, el calor coincide con el aumento de la entalpía
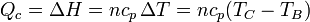
- El subíndice "c" viene de que este calor se intercambia con un supuesto foco caliente.
- En la expulsión de los gases D→A el aire sale a una temperatura mayor que a la entrada, liberando posteriormente un calor | Qf | al ambiente. En el modelo de sistema cerrado, en el que nos imaginamos que es el mismo aire el que se comprime una y otra vez en el motor, modelamos esto como que el calor | Qf | es liberado en el proceso D→A, por enfriamiento. El valor absoluto viene de que, siendo un calor que sale del sistema al ambiente, su signo es negativo. Su valor, análogamente al caso anterior, es
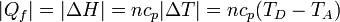
- El subíndice "f" viene de que este calor se cede a un foco frío, que es el ambiente.
3.2 Trabajo realizado
En este ciclo (a diferencia de lo que ocurre en el ciclo Otto) se realiza trabajo en los cuatro procesos. En dos de ellos el gtrabajo es positivo y en dos es negativo.
- En la compresión de la mezcla A→B, se realiza un trabajo positivo sobre el gas. Al ser un proceso adiabático, todo este trabajo se invierte en incrementar la energía interna, elevando su temperatura:
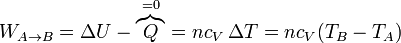
- En la combustión el gas se expande a presión constante, por lo que el trabajo es igual a la presión por el incremento de volumen, cambiado de signo:
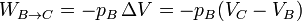
- Este trabajo es negativo, ya que es el aire, al expandirse, el que realiza el trabajo. Aplicando la ecuación de los gases ideales y que pB = pC, podemos escribir este trabajo como
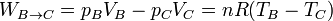
- En la expansión C→D es el aire el que realiza trabajo sobre el pistón. De nuevo este trabajo útil equivale a la variación de la energía interna
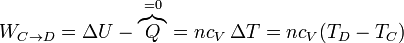
- este trabajo es negativo, por ser el sistema el que lo realiza.
- En el enfriamiento en el exterior tenemos una compresión a presión constante:
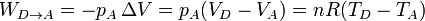
- El trabajo neto realizado sobre el gas es la suma de los cuatro términos
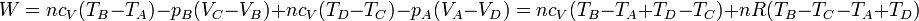
Aplicando la ley de Mayer
este trabajo se puede expresar como
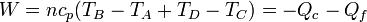
Por tratarse de un proceso cíclico, la variación de la energía interna es nula al finalizar el ciclo. Esto implica que el calor neto introducido en el sistema esigual al trabajo neto realizado por este, en valor absoluto.
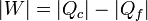
3.3 Rendimiento
4 Eficiencia en función de las temperaturas
5 Eficiencia en función de la relación de presiones
6 Enlaces
- Artículo sobre el ciclo Brayton en el curso de Termodinámica del MIT.