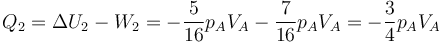Compresión lineal de un gas
De Laplace
| Línea 4: | Línea 4: | ||
<center><math>p = 3p_A-\frac{2p_AV}{V_A}</math></center> | <center><math>p = 3p_A-\frac{2p_AV}{V_A}</math></center> | ||
| - | + | La compresión continúa hasta que la presión vale <math>p_B = 2p_A</math>. | |
# Trace la gráfica del proceso en un diagrama PV. | # Trace la gráfica del proceso en un diagrama PV. | ||
| Línea 17: | Línea 17: | ||
<center><math>p = a + b V\,</math>{{qquad}}{{qquad}}<math>a = 3p_A\,</math>{{qquad}}{{qquad}}<math>b = -\frac{2p_A}{V_A}</math></center> | <center><math>p = a + b V\,</math>{{qquad}}{{qquad}}<math>a = 3p_A\,</math>{{qquad}}{{qquad}}<math>b = -\frac{2p_A}{V_A}</math></center> | ||
| - | es claro que la gráfica del proceso es un segmento rectilíneo. El punto inicial del segmento es <math>(p_A,V_A)</math> y el punto final corresponde a <math> | + | es claro que la gráfica del proceso es un segmento rectilíneo. El punto inicial del segmento es <math>(p_A,V_A)</math> y el punto final corresponde a <math>p_B=2p_A</math> y al volumen |
<center> | <center> | ||
| - | <math> | + | <math>p_B=2p_A = 3p_A - \frac{2p_AV_B}{V_A} \qquad\Rightarrow\qquad V_B = \frac{V_A}{2}</math></center> |
Por tanto el volumen final es la mitad del inicial, mientras que la presión es el doble. | Por tanto el volumen final es la mitad del inicial, mientras que la presión es el doble. | ||
| Línea 30: | Línea 30: | ||
En el estado final | En el estado final | ||
| - | <center><math> | + | <center><math>T_B = \frac{p V}{n R} = \frac{(2p_A)(V_A/2)}{n R} = \frac{p_AV_A}{n R} = T_A</math></center> |
Por tanto, la temperatura final es igual a la inicial. | Por tanto, la temperatura final es igual a la inicial. | ||
| Línea 38: | Línea 38: | ||
===Trabajo=== | ===Trabajo=== | ||
| - | El trabajo realizado sobre el gas en un proceso | + | El trabajo realizado sobre el gas en un proceso cuasiestático es igual a la integral |
<center><math>W = - \int_{V_i}^{V_f}p\,\mathrm{d}V</math></center> | <center><math>W = - \int_{V_i}^{V_f}p\,\mathrm{d}V</math></center> | ||
| Línea 112: | Línea 112: | ||
<center><math>Q_1 = \Delta U_1 - W_1 = \frac{5}{16}p_AV_A-\frac{5}{16}p_AV_A = 0</math></center> | <center><math>Q_1 = \Delta U_1 - W_1 = \frac{5}{16}p_AV_A-\frac{5}{16}p_AV_A = 0</math></center> | ||
| - | Este proceso es globalmente adiabático, aunque en pasos intermedios se intercambie calor con el entorno. | + | Este proceso es globalmente adiabático, aunque en pasos intermedios se intercambie calor con el entorno. |
====Segundo tramo==== | ====Segundo tramo==== | ||
Revisión de 12:11 1 abr 2015
Contenido[ocultar] |
1 Enunciado
Se tiene un volumen VA de un gas ideal diatómico a una presión pA y una temperatura TA encerrado en un recipiente con un pistón móvil. Este gas se comprime reversiblemente según la ley
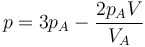
La compresión continúa hasta que la presión vale pB = 2pA.
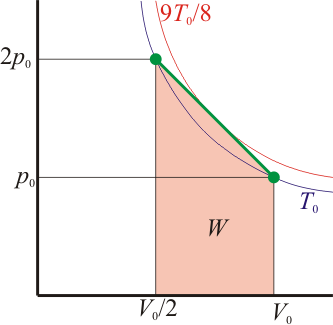
- Trace la gráfica del proceso en un diagrama PV.
- Calcule la temperatura final del proceso.
- Calcule el trabajo neto realizado sobre el gas, la variación de su energía interna y el calor que entra en el gas durante el proceso.
- ¿Para qué volumen durante el proceso la temperatura es máxima? Halle el valor de esta temperatura máxima.
- Separando el proceso en dos: uno hasta que alcanza la temperatura máxima y otro de ahí hasta el final, halle W, ΔU y Q en cada uno de los dos subprocesos.
2 Representación gráfica
Dado que la presión depende del volumen en la forma
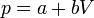
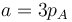
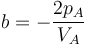
es claro que la gráfica del proceso es un segmento rectilíneo. El punto inicial del segmento es (pA,VA) y el punto final corresponde a pB = 2pA y al volumen
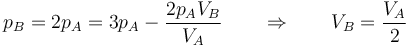
Por tanto el volumen final es la mitad del inicial, mientras que la presión es el doble.
3 Temperatura final
Obtenemos la temperatura final a partir de la ecuación de los gases ideales. Inicialmente tenemos
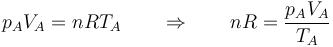
En el estado final
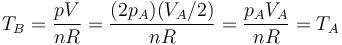
Por tanto, la temperatura final es igual a la inicial.
4 Trabajo, energía y calor
4.1 Trabajo
El trabajo realizado sobre el gas en un proceso cuasiestático es igual a la integral
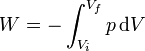
En nuestro caso
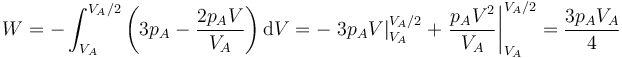
Es muy fácil llegar a este resultado de forma gráfica, ya que el área bajo la curva es la de un trapecio de altura VA / 2, base menor pA y base mayor 2pA. El área de este trapecio es
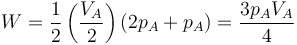
4.2 Energía interna
Por tratarse de un gas ideal, la variación en la energía interna solo depende de la temperatura inicial y la final
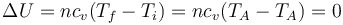
Puesto que la temperatura inicial y la final son la misma, no hay variación en la energía interna del gas.
4.3 Calor
Una vez que tenemos el trabajo y la variación de la energía interna, hallamos el calor empleando el primer principio de la termodinámica
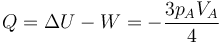
En este proceso se realiza trabajo, pero puesto que la temperatura del sistema es la misma al principio y al final, ese trabajo sale del sistema en forma de calor. Este proceso, no obstante, no es isotermo, ya que la temperatura del sistema cambia en los estados intermedios.
5 Temperatura máxima
La temperatura del gas en cada estado del proceso la hallamos por la ley de los gases ideales
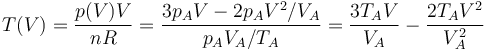
La gráfica de esta función tiene una forma parabólica, con un máximo en algún punto intermedio entre el estado inicial y el final. Hallamos la posición del máximo igualando la derivada a cero.
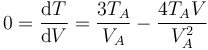

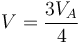
Este volumen corresponde al punto medio entre el estado inicial y el final. La temperatura en este punto es
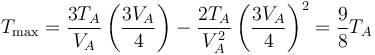
La temperatura del gas, por tanto, aumenta desde TA a (9/8) de este valor y a partir de ahí vuelve a disminuir al valor inicial
6 División en dos tramos
De acuerdo con el resultado del apartado anterior, cuando se comprime el gas entre VA y 3VA / 4, la temperatura aumenta, disminuyendo entre ese valor y VA / 2. Si consideramos los dos procesos por separado obtenemos los resultados siguientes:
6.1 Trabajo
6.1.1 Primer tramo
Hallamos el trabajo empleando de nuevo la fórmula del trapecio (o la integral, que es equivalente). Este trapecio tiene altura VA / 4 y bases pA y 3pA / 2
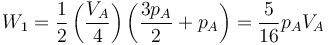
6.1.2 Segundo tramo
Para la segunda parte del trayecto podemos hallar el trabajo como el área de un nuevo trapecio o considerando que es el trabajo restante hasta completar el total. En cualquier caso, el resultado es
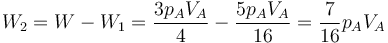
6.2 Energía
Los dos tramos no son isotermos, ya que la temperatura primero sube y luego baja, por lo que hay variación en la energía interna en cada uno dellos.
6.2.1 Primer tramo
Por tratarse de un gas ideal diatómico, la variación de energía es
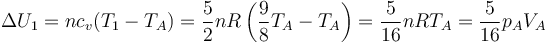
6.2.2 Segundo tramo
Operando del mismo modo
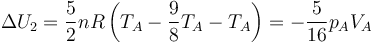
Resulta igual y de signo contrario a la anterior, como corresponde a que la variación neta de energía es nula.
6.3 Calor
Para calcular el calor en cada tramo del proceso aplicamos el primer principio de la termodinámica
6.3.1 Primer tramo
El calor en este proceso es
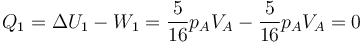
Este proceso es globalmente adiabático, aunque en pasos intermedios se intercambie calor con el entorno.
6.3.2 Segundo tramo
El calor en este parte se halla de la misma forma