Propiedades del agua
De Laplace
(→Equilibrio agua-vapor) |
(→Equilibrio agua-vapor) |
||
| Línea 164: | Línea 164: | ||
| 101.3 | | 101.3 | ||
|} | |} | ||
| + | |||
| + | Para entender el papel de la curva de saturación consideraremos tres situaciones: Un recipiente hermético rígido solo con agua; un recipiente solo con agua cerrado por un pistón; y un recipiente abierto al aire. | ||
| + | |||
| + | * Si tenemos un recipiente rígido en el que se ha hecho el vacío absoluto y posteriormente se introduce agua sin llenarlo por completo, se produce rápidamente la formación de vapor, ya que algunas moléculas tienen energía suficiente para abandonar la fase líquida. Este proceso se para cuando se alcanza la saturación. Cuando la presión y la tempratura son las de saturación se produce el equilibrio de fases. Cualquier nueva molécula que escapa del agua es compensada por una que vuelve a ella. | ||
==Diagrama V-T y p-V== | ==Diagrama V-T y p-V== | ||
[[Categoría:Introducción a la termodinámica (GIE)]] | [[Categoría:Introducción a la termodinámica (GIE)]] | ||
Revisión de 21:39 17 feb 2014
Contenido |
1 Introducción
La importancia del agua en la ingeniería difícilmente puede ser exagerada, ya que aparece en toda clase de aplicaciones. En el campo de la termodinámica técnica, es el componente esencial de las máquinas de vapor, entre otras aplicaciones.
A modo de introducción, en este artículo se comentan algunas de las propiedades de esta sustancia. En especial, sus aspectos termodinámicos de su fase líquida, de su fase gaseosa y de la situación y equilibrio entre ambas.
2 Fases del agua
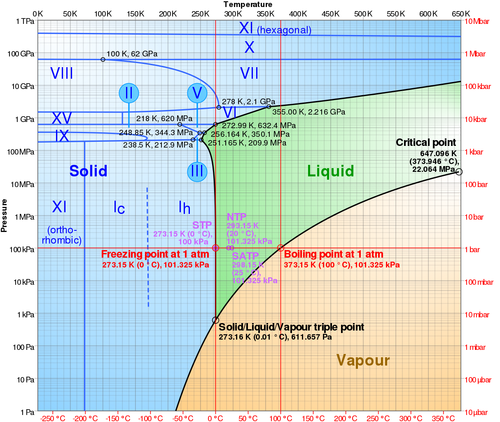
En sus estados más habituales, el agua se presenta en tres formas: una sólida (hielo), una líquida (llamada simplemente agua) y una gaseosa (vapor de agua). No son los únicos estados posibles, ya que existen diferentes formas de hielo, según como cristalice.
A una presión ambiente de 101 kPa (1 atm), el agua se encuentra en forma de hielo por debajo de la temperatura de fusión 273.15 K (0.00°C) y de agua por encima de esta temperatura hasta la temperatura de ebullición 373.13K (99.98°C). Por encima de esta temperatura se encuentra en forma de vapor de agua.
La temperatura de fusión y la de ebullición son funciones de la presión.
- A una presión mayor la temperatura de ebullición se eleva. Así, a una presión de 400 kPa, la temperatura de ebullición es de 417 K (144°C). Este es el principio de las ollas a presión, que consiguen alcanzar una mayor temperatura en forma líquida.
- La temperatura de fusión depende mucho menos de la presión. El agua es excepcional respecto a la mayoría de las sustancias en cuanto a que al aumentar la presión la temperatura de fusión disminuye (normalmente aumenta). Este es el principio que permite patinar sobre hielo. El hielo no es para nada resbaladizo. Sin embargo, al ejercerse una presión sobre él se forma una fina capa de agua que permite el deslizamiento.
Una mezcla de agua y hielo a la temperatura de fusión se encuentra en equilibrio térmico. Ni el hielo se derrite, ni el gua se congela. Asimismo, a la temperatura de ebullición, el agua se encuentra en equilibrio térmico con el vapor de agua.
Existe una presión a la cual la temperatura de fusión y la de ebullición se igualan. A la presión de 611.73 Pa (6.11 mbar) y la temperatura de 273.16 K se produce el equilibrio térmico entre las tres fases. A este punto se lo conoce como punto triple del agua.
3 Propiedades del agua
Si tenemos una cantidad de agua (líquida) a una cierta temperatura y la presión a la que se encuentra es superior a la que produciría ebullición a esa temperatura, se dice que es un líquido comprimido (ya que la presión exterior la mantiene en estado líquido) o líquido subenfriado (ya que se encuentra por debajo de su temperatura de ebullición).
Esta es la situación habitual entre 0°Cy 100°C a la presión de una atmósfera. A esta presión, el agua tiene una densidad que es aproximadamente igual a 1000 kg/m³. Esta densidad, no obstante, depende ligeramente de la temperatura
| T(°C) | ρ (kg/m³) | T(°C) | ρ (kg/m³) | T(°C) | ρ (kg/m³) |
|---|---|---|---|---|---|
| 0.01 | 999.8 | 35 | 994.1 | 70 | 978 |
| 5 | 1000 | 40 | 992.3 | 75 | 975 |
| 10 | 999.7026 | 45 | 990.2 | 80 | 972 |
| 15 | 999.1026 | 50 | 988 | 85 | 968 |
| 20 | 998.2071 | 55 | 986 | 90 | 965 |
| 25 | 997.0479 | 60 | 983 | 95 | 962 |
| 30 | 995.6502 | 65 | 980 | 100 | 958 |
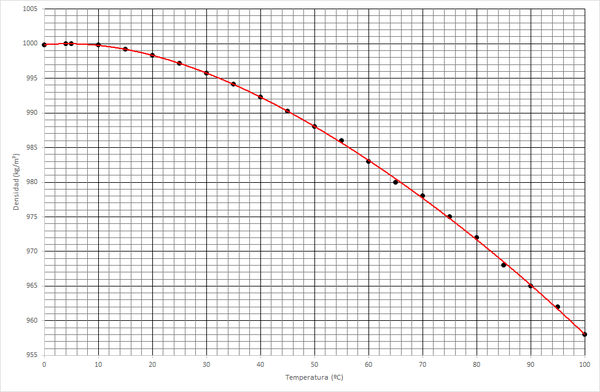
De esta tabla y esta gráfica, salta a la vista otra propiedad del agua que la hace diferente al resto de sustancias: la densidad no disminuye monótonamente, sino que tiene un máximo. Esto quiere decir que, en general el agua caliente es más ligera que el agua fría y por tanto, tenderá a ir hacia la superficie, pero a temperaturas próximas a 0°C la tendencia se invierte y el agua más caliente es más pesada que la fría. El máximo de densidad se alcanza a 4ºC. Esto es lo que se conoce como anomalía térmica del agua.
Esta propiedad permite que el agua de un lago no se congele por completo. Si no hubiera anomalía, el agua más caliente quedaría en la superficie, donde se iría enfriando, cayendo al fondo y siendo sustituida por agua caliente, que se enfriaría a su vez, etc, hasta que todo quedara congelado. Al existir la anomalía esto no se produce porque el agua más caliente se queda abajo y el calor solo se pierde por conducción y no por convección, lo que es mucho más lento.
A partir de estos valores puede hallarse el coeficiente de dilatación volumétrica
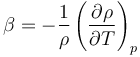
que a 4°C se anula y a 20°C vale
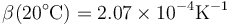
El agua es un líquido que se puede tratar como incompresible, ya que su coeficiente de compresibilidad es extremadamente pequeño. A 20°C y 100 kPa
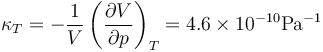
o, equivalentemente, su módulo de compresibilidad es
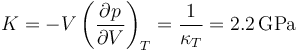
Esto quiere decir que para rangos ordinarios de presiones puede suponerse que el volumen (o la densidad) dependen exclusivamente de la temperatura, pero que incluso esta dependencia es pequeña.
El agua posee un calor específico que también es función de la temperatura pero que, de nuevo, varía poco en el el rango de 0°C a 100°C, siendo su valor
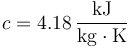
4 Propiedades del vapor de agua
Por encima de la temperatura de ebullición, el agua se encuentra en forma gaseosa. Al ser la temperatura superior a Tb, se dice que el vapor está sobrecalentado.
El vapor de agua no siempre se puede tratar como un gas ideal, ya que la cohesión entre sus moléculas provoca que se aleje de la hipótesis de gas ideal (que supone que las partículas no interactúan entre sí). No obstante, para altas temperaturas y bajas presiones (comparadas con las de saturación) se puede hacer esta aproximación, al menos como primera estimación de los resultados.
5 Equilibrio agua-vapor
Cuando consideramos posibles situaciones con agua y vapor de agua (no consideramos el hielo) tenemos tres posibilidades: que tengamos solo agua, que tengamos un equilibrio de agua y vapor, o que tengamos solo vapor.
El criterio que nos permite establecer cuál de las tres situaciones se va a dar lo da la curva de saturación. Esta curva da la temperatura de ebullición como función de la presión (o viceversa)
| psat(kPa) |
|---|---|
| 0 | 0.6105 |
| 5 | 0.8722 |
| 10 | 1.228 |
| 20 | 2.338 |
| 30 | 4.243 |
| 40 | 7.376 |
| 50 | 12.33 |
| 60 | 19.92 |
| 70 | 31.16 |
| 80 | 47.34 |
| 90 | 70.10 |
| 100 | 101.3 |
Para entender el papel de la curva de saturación consideraremos tres situaciones: Un recipiente hermético rígido solo con agua; un recipiente solo con agua cerrado por un pistón; y un recipiente abierto al aire.
- Si tenemos un recipiente rígido en el que se ha hecho el vacío absoluto y posteriormente se introduce agua sin llenarlo por completo, se produce rápidamente la formación de vapor, ya que algunas moléculas tienen energía suficiente para abandonar la fase líquida. Este proceso se para cuando se alcanza la saturación. Cuando la presión y la tempratura son las de saturación se produce el equilibrio de fases. Cualquier nueva molécula que escapa del agua es compensada por una que vuelve a ella.





