Ciclo de Stirling (GIE)
De Laplace
| Línea 32: | Línea 32: | ||
: '''D→A''' Se enfría el gas manteniendo constante su volumen hasta que su temperatura vuelve a ser la inicial. Es un tramo vertical hacia abajo, cerrando el ciclo. | : '''D→A''' Se enfría el gas manteniendo constante su volumen hasta que su temperatura vuelve a ser la inicial. Es un tramo vertical hacia abajo, cerrando el ciclo. | ||
| + | Los valores de las presiones, temperaturas y volúmenes de cada vértice del ciclo son los siguientes. Partimos del estado A, de cual conocemos las tres magnitudes | ||
| + | <center><math>p_A = 10^5\,\mathrm{Pa}\qquad V_A = 5\times 10^{-4}\mathrm{m}^3\qquad T_A = 300\,\mathrm{K}</math></center> | ||
| + | |||
| + | En el estado B tenemos la temperatura y el volumen | ||
| + | |||
| + | <center><math>T_B = T_A=300\,\mathrm{K} \qquad V_B = 5\times 10^{-5}\mathrm{m}^3</math></center> | ||
| + | |||
| + | y por la ley de los gases ideales hallamos la presión | ||
| + | |||
| + | <center><math>\frac{p_AV_A}{T_A}=\frac{p_BV_B}{T_B}\qquad\Rightarrow\qquad p_B = 10^6\,\mathrm{Pa}</math></center> | ||
| + | |||
| + | A temperatura constante, si el volumen se divide por 10, la presión se multiplica por el mismo factor. | ||
| + | |||
| + | En el estado C de nuevo tenemos la temperatura y el volumen | ||
| + | |||
| + | <center><math>T_C = 450\,\mathrm{K} \qquad V_C = V_B = 5\times 10^{-5}\mathrm{m}^3</math></center> | ||
| + | |||
| + | y hallamos la presión del mismo modo | ||
| + | |||
| + | <center><math>\frac{p_CV_C}{T_C}=\frac{p_BV_B}{T_B}\qquad\Rightarrow\qquad p_C = 1.5\times 10^6\,\mathrm{Pa}</math></center> | ||
| + | |||
| + | En este caso la temperatura se multiplica por un factor 1.5 y lo mismo ocurre con la presión. | ||
| + | |||
| + | En el último vértice de nuevo tenemos la temperatura y el volumen | ||
| + | |||
| + | <center><math>T_D = 450\,\mathrm{K} \qquad V_D = V_A = 5\times 10^{-4}\mathrm{m}^3</math></center> | ||
| + | |||
| + | y resulta la presión | ||
| + | |||
| + | <center><math>\frac{p_AV_A}{T_A}=\frac{p_DV_D}{T_D}\qquad\Rightarrow\qquad p_D = 1.5\times 10^5\,\mathrm{Pa}</math></center> | ||
| + | |||
| + | Podemos recoger estos estados en la siguiente tabla: | ||
==Trabajo y calor== | ==Trabajo y calor== | ||
==Rendimiento== | ==Rendimiento== | ||
Revisión de 17:04 27 mar 2012
Contenido |
1 Enunciado
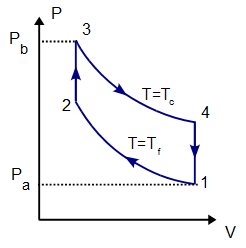
Un Ciclo de Stirling ideal, sin regeneración, está formado por los siguientes pasos:
Inicialmente tenemos 500 cm³ de aire a 300 K y 100 kPa (estado A)
- A→B Se comprime el gas de forma isoterma, hasta que se reduce su volumen a 50 cm³
- B→C Se calienta el gas hasta una temperatura de 450 K, manteniendo fijado su volumen.
- C→D Se expande el gas a temperatura constante hasta que vuelve a su volumen inicial.
- D→A Se enfría el gas manteniendo constante su volumen hasta que su temperatura vuelve a ser la inicial
Para este ciclo.
- Indique gráficamente como sería en un diagrama pV.
- Calcule el trabajo y el calor que entran en el sistema en cada uno de los cuatro pasos.
- Calcule el rendimiento del ciclo.
En un ciclo de Stirling con regeneración, el calor liberado en el proceso D\→A no se pierde sino que se emplea para efectuar el calentamiento en B→C
- Calcule el rendimiento del ciclo de Stirling con regeneración. ¿Es mayor o menor que el de una máquina de Carnot que opere entre las mismas temperaturas?
2 Representación gráfica
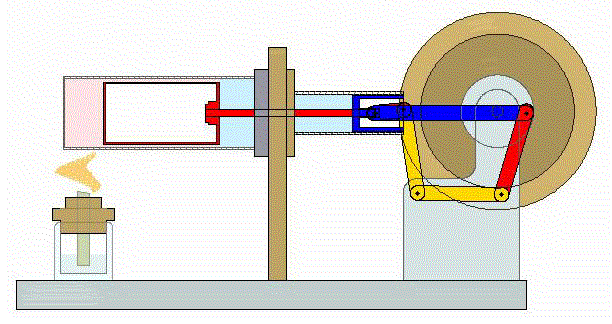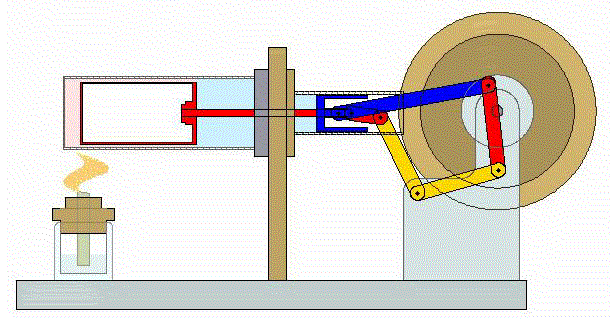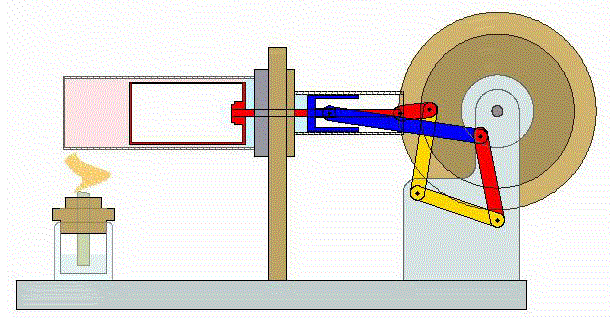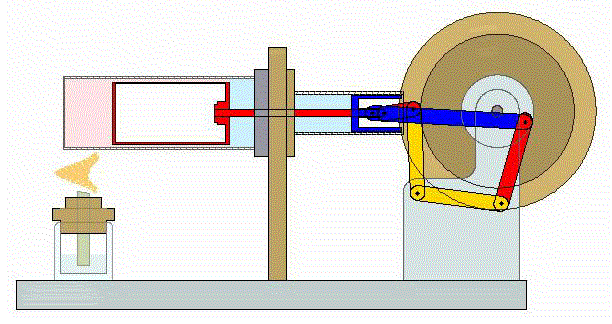
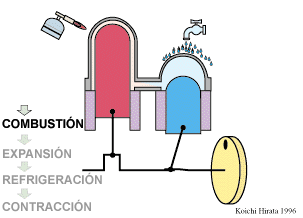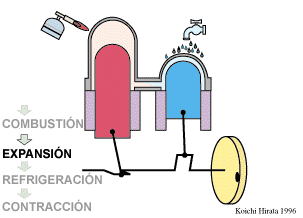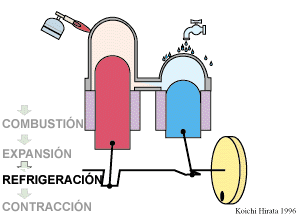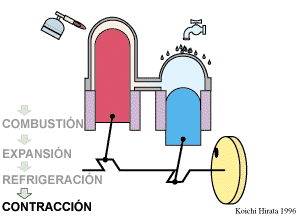
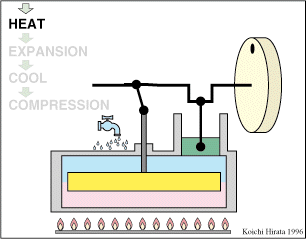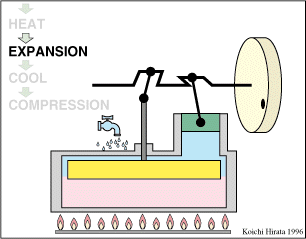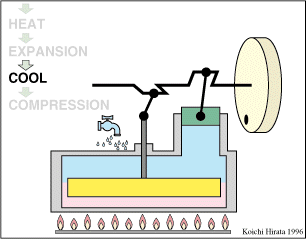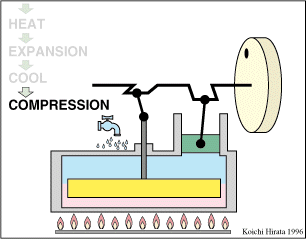
El proceso se compone de cuatro pasos, cuya representación gráfica en un diagrama pV es la siguiente:
- A→B Se comprime el gas de forma isoterma, hasta que se reduce su volumen a 50 cm³. Esto corresponde a un tramo de hipérbola correspondiente a la temperatura indicada.
- B→C Se calienta el gas hasta una temperatura de 450 K, manteniendo fijado su volumen. Gráficamente, es una línea vertical entre las dos isotermas.
- C→D Se expande el gas a temperatura constante hasta que vuelve a su volumen inicial. Otro arco de hipérbola ahora recorrido hacia volúmenes crecientes.
- D→A Se enfría el gas manteniendo constante su volumen hasta que su temperatura vuelve a ser la inicial. Es un tramo vertical hacia abajo, cerrando el ciclo.
Los valores de las presiones, temperaturas y volúmenes de cada vértice del ciclo son los siguientes. Partimos del estado A, de cual conocemos las tres magnitudes
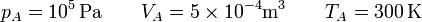
En el estado B tenemos la temperatura y el volumen

y por la ley de los gases ideales hallamos la presión
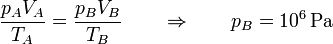
A temperatura constante, si el volumen se divide por 10, la presión se multiplica por el mismo factor.
En el estado C de nuevo tenemos la temperatura y el volumen
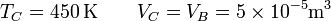
y hallamos la presión del mismo modo
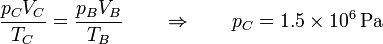
En este caso la temperatura se multiplica por un factor 1.5 y lo mismo ocurre con la presión.
En el último vértice de nuevo tenemos la temperatura y el volumen
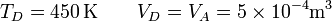
y resulta la presión
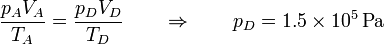
Podemos recoger estos estados en la siguiente tabla:
3 Trabajo y calor
4 Rendimiento
En este proceso se absorbe calor en al calentamiento isócoro y la expansión isoterma, y se cede en los otros dos procesos. El valor neto del calor absorbido es
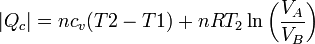
y del cedido
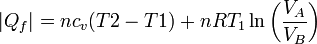
de forma que el rendimiento es

siendo r la relación de compresión.
Podemos comprobar que este rendimiento es siempre menor que el de una máquina reversible que opere entre estas dos temperaturas
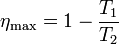
siendo la diferencia