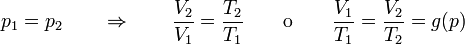Los gases ideales (GIE)
De Laplace
(Diferencias entre revisiones)
(Página creada con '==Introducción== ==Presión y temperatura de un gas== ==Ecuación de estado== ===Ley de Charles=== ===Ley de Boyle=== ===Ecuación general=== ===Aplicaciones. Termómetro a vol…') |
(→Ecuación de estado) |
||
| Línea 2: | Línea 2: | ||
==Presión y temperatura de un gas== | ==Presión y temperatura de un gas== | ||
==Ecuación de estado== | ==Ecuación de estado== | ||
| - | |||
===Ley de Boyle=== | ===Ley de Boyle=== | ||
| + | La ley de Boyle (también conocida como ley de Boyle-Mariotte), nos dice que si en un gas ideal se mantiene la temperatura constante, la presión del gas es inversamente proporcional al volumen que ocupa, lo que se expresa | ||
| + | |||
| + | <center><math>T_1 = T_2\qquad\Rightarrow\qquad \frac{p_2}{p_1}=\frac{V_1}{V_2}\qquad \mbox{o}\qquad p_1V_1 = p_2V_2=f(T)</math></center> | ||
| + | |||
| + | Si aquí introducimos magnitudes específicas, dividiendo por la masa de gas, nos queda | ||
| + | |||
| + | <center><math>\frac{p_1}{\rho_1} = \frac{p_2}{\rho_2}</math></center> | ||
| + | |||
| + | o, equivalentemente, que la densidad de un gas ideal es proporcional a su presión, a temperatura constante | ||
| + | |||
| + | <center><math>p = f(T)\rho\qquad\qquad pV = F(T)</math></center> | ||
| + | |||
| + | con <math>F(T)</math> una cierta función de la temperatura y proporcional a la masa de gas. | ||
| + | ===Ley de Charles=== | ||
| + | La ley de Charles (también llamada de Gay-Lussac, de Charles-Gay-Lussac, o de los volúmenes) afirma que en un gas ideal a presión constante, el volumen que ocupa el gas es proporcional a la temperatura que tiene | ||
| + | |||
| + | <center><math>p_1=p_2\qquad\Rightarrow\qquad \frac{V_2}{V_1}= \frac{T_2}{T_1}\qquad \mbox{o}\qquad \frac{V_1}{T_1}=\frac{V_2}{T_2}= g(p)</math></center> | ||
===Ecuación general=== | ===Ecuación general=== | ||
===Aplicaciones. Termómetro a volumen constante=== | ===Aplicaciones. Termómetro a volumen constante=== | ||
| + | |||
==Gases no ideales. Compresibilidad== | ==Gases no ideales. Compresibilidad== | ||
==Trabajo, calor y energía== | ==Trabajo, calor y energía== | ||
Revisión de 01:04 27 ene 2012
Contenido |
1 Introducción
2 Presión y temperatura de un gas
3 Ecuación de estado
3.1 Ley de Boyle
La ley de Boyle (también conocida como ley de Boyle-Mariotte), nos dice que si en un gas ideal se mantiene la temperatura constante, la presión del gas es inversamente proporcional al volumen que ocupa, lo que se expresa
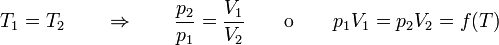
Si aquí introducimos magnitudes específicas, dividiendo por la masa de gas, nos queda
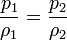
o, equivalentemente, que la densidad de un gas ideal es proporcional a su presión, a temperatura constante

con F(T) una cierta función de la temperatura y proporcional a la masa de gas.
3.2 Ley de Charles
La ley de Charles (también llamada de Gay-Lussac, de Charles-Gay-Lussac, o de los volúmenes) afirma que en un gas ideal a presión constante, el volumen que ocupa el gas es proporcional a la temperatura que tiene