Transferencia reversible de calor
De Laplace
(Diferencias entre revisiones)
(→Contacto directo) |
(→Variación de entropía) |
||
| Línea 29: | Línea 29: | ||
<center><math> | <center><math> | ||
| - | \Delta S = \Delta S_1 + \Delta S_2 = mc\ln\left(\frac{T_f}{T_1}\right)+ mc\ln\left(\frac{T_f}{ | + | \Delta S = \Delta S_1 + \Delta S_2 = mc\ln\left(\frac{T_f}{T_1}\right)+ mc\ln\left(\frac{T_f}{T_0}\right) = mc\ln\left(\frac{T_f^2}{T_0T_1}\right)</math></center> |
Sustituyendo los valores numéricos | Sustituyendo los valores numéricos | ||
Revisión de 11:26 28 may 2010
Contenido |
1 Enunciado
Se tienen dos recipientes adiabáticos conteniendo 500 g de agua cada uno, a 0°C y 100°C, respectivamente.
- Se ponen en contacto a través de una pared diaterma. Halle:
- La temperatura final del agua.
- La cantidad de calor transferida.
- La variación de entropía en el proceso.
- Suponga ahora que el contacto térmico no se hace directamente sino a través de una máquina térmica reversible que usa los recipientes como foco caliente y foco frío. Teniendo en cuenta que todos los procesos son reversibles
- Halle la temperatura final del agua
- Calcule el calor cedido por el agua caliente y el absorbido por el agua fría
- Determine el trabajo que se puede extraer del sistema.
2 Contacto directo
En el primer proceso tenemos una transferencia de calor del foco caliente al foco frío sin producción alguna de trabajo. Todo el calor que cede el foco caliente lo absorbe el foco frío.
2.1 Temperatura final
Puesto que el único intercambio de calor es interno



2.2 Calor transferido
El calor que cede el foco caliente es
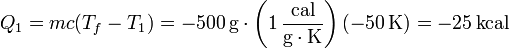
Este calor es negativo puesto que sale del sistema. la misma cantidad de calor entra en el foco frío.
2.3 Variación de entropía
La variación de entropía será la suma de lo que cambia la del agua aclaiente más lo que lo hace la del agua fría. El resultado es
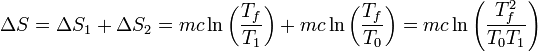
Sustituyendo los valores numéricos
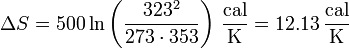
Esa variación es positiva, lo que indica que el proceso es posible e irreversible.





