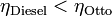Ciclo Diesel
De Laplace
(→Caso práctico) |
(→Comparación con el ciclo Otto) |
||
| (22 ediciones intermedias no se muestran.) | |||
| Línea 73: | Línea 73: | ||
==Caso práctico== | ==Caso práctico== | ||
| - | Vamos a considerar un ciclo Diesel en la que el aire a la entrada está a una presión de 1 atm y una temperatura de 17°C; la razón de compresión es 18 y la de combustión vale 2. El volumen máximo de la cámara es de 1900 cm³. Vamos a determinar los volúmenes, presiones y temperaturas de cada vértice del ciclo, así como su rendimiento y el calor y el trabajo intercambiados por el motor. | + | [[Imagen:ciclo-diesel-exacto.png|354px|right]]Vamos a considerar un ciclo Diesel en la que el aire a la entrada está a una presión de 1 atm y una temperatura de 17°C; la razón de compresión es 18 y la de combustión vale 2. El volumen máximo de la cámara es de 1900 cm³. Vamos a determinar los volúmenes, presiones y temperaturas de cada vértice del ciclo, así como su rendimiento y el calor y el trabajo intercambiados por el motor. |
| + | |||
| + | ===Estado inicial=== | ||
| + | Como punto de partida del ciclo de cuatro pasos tenemos que el gas a temperatura y presión ambientes llena el cilindro | ||
| + | |||
| + | <center><math>T_A = 290\,\mathrm{K}</math>{{qquad}}{{qquad}}<math>V_A = 1900\,\mathrm{cm}^3</math>{{qquad}}{{qquad}}<math>p_A=1\,\mathrm{atm}</math></center> | ||
| + | |||
| + | El número de moles contenidos en el cilindro es | ||
| + | |||
| + | <center><math>n = \frac{p_AV_A}{RT_A}=0.0799</math></center> | ||
| + | |||
| + | ===Compresión adiabática=== | ||
| + | Tras la compresión, el volumen del cilindro se reduce según la razón de compresión | ||
| + | |||
| + | <center><math>r = 18\,</math>{{tose}}<math>V_B = \frac{V_A}{r}=105.6\,\mathrm{cm}^3</math></center> | ||
| + | |||
| + | La temperatura al final la compresión la obtenemos de la ley de Poisson | ||
| + | |||
| + | <center><math>T_BV_B^{\gamma-1} = T_AV_A^{\gamma-1}\,</math>{{tose}}<math>T_B = T_A r^{\gamma-1}=921.5\,\mathrm{K}</math></center> | ||
| + | |||
| + | y la presión en este punto la hallamos mediante la ley de los gases ideales | ||
| + | |||
| + | <center><math>p_B = nR\frac{T_B}{V_B} = \frac{p_AV_A}{T_A}\frac{T_B}{V_B}=p_Ar^\gamma = 57.2\,\mathrm{atm}</math></center> | ||
| + | |||
| + | ===Expansión isóbara=== | ||
| + | En el proceso de calentamiento, la presión se mantiene constante, por lo que | ||
| + | |||
| + | <center><math>p_C=p_B=57.2\,\mathrm{atm}</math></center> | ||
| + | |||
| + | mientras que el volumen lo da la relación de combustión | ||
| + | |||
| + | <center><math>r_c = 2\,</math>{{tose}}<math>V_C = r_cV_B=211.1\,\mathrm{cm}^3</math></center> | ||
| + | |||
| + | y la temperatura la ley de los gases ideales (o la ley de Charles, en este caso) | ||
| + | |||
| + | <center><math>\frac{V_C}{T_C}=\frac{V_B}{T_B}</math>{{tose}} <math>T_C = T_B rc = 1843\,\mathrm{K}</math></center> | ||
| + | |||
| + | ===Expansión adiabática=== | ||
| + | Durante la bajada del pistón el gas se enfría adiabáticamente. La temperatura al final del proceso la da la ley de Poisson, combinada con el que sabemos que el volumen al final es el mismo que antes de empezar la compresión | ||
| + | |||
| + | <center> | ||
| + | <math>V_D = V_A = 1900\,\mathrm{cm}^3</math>{{qquad}}{{qquad}}<math>T_D = T_C\left(\frac{V_C}{V_D}\right)^{\gamma-1} = 765.3\,\mathrm{K}</math></center> | ||
| + | |||
| + | La presión en este estado es | ||
| + | |||
| + | <center><math>p_D = \frac{nRT_D}{V_D}=\frac{p_AV_AT_D}{T_AV_D}=p_A\frac{T_D}{T_A}=2.64\,\mathrm{atm}</math></center> | ||
| + | |||
| + | ===Enfriamiento a V constante=== | ||
| + | En un motor diésel real el aire quemado y caliente es expulsado por el tubo de escape, liberando calor al ambiente y siendo sustituido por nuevo aire frío. En el ciclo Diesel ideal nos imaginamos que el aire recircula, volviendo al estado A, intercambiando sólo el calor con el ambiente. | ||
| + | |||
| + | ===Balance energético=== | ||
| + | ====Calor absorbido==== | ||
| + | El calor procedente del foco caliente es absorbido en la expansión a presión constante y es igual a | ||
| + | |||
| + | <center><math>Q_c = nc_p(T_C-T_B) = \frac{\gamma}{\gamma-1}nR(T_C-T_B) = \frac{\gamma}{\gamma-1}(p_CV_C-p_BV_B)=21.13\,\mathrm{kJ}</math></center> | ||
| + | |||
| + | donde hemos usado que | ||
| + | |||
| + | <center><math>\frac{c_p}{R}=\frac{c_p}{c_p-c_V}=\frac{c_p/c_V}{c_p/c_V-1}=\frac{\gamma}{\gamma-1}</math></center> | ||
| + | |||
| + | que para <math>\gamma=1.4</math> da el resultado conocido <math>c_p=3.5R</math>. | ||
| + | |||
| + | Un resultado más exacto para un proceso a presión constante, sin hacer uso de la hipótesis de gas ideal, consistiría en igualar el calor a la variación en la entalpía | ||
| + | |||
| + | <center><math>Q_c = \Delta H = H_C-H_B\,</math></center> | ||
| + | |||
| + | y aplicar valores tabulados de la entalpía del aire para las presiones y temperaturas de los estados B y C. | ||
| + | |||
| + | ====Calor cedido==== | ||
| + | El calor que se intercambia con el foco frío se cede en el enfriamiento a volumen constante | ||
| + | |||
| + | <center><math>|Q_f| = nc_v(T_D-T_A) = nR(T_D-T_A) = \frac{1}{\gamma-1}(p_DV_D-p_AV_A)=7.79\,\mathrm{kJ}</math></center> | ||
| + | |||
| + | donde, como antes, hemos empleado la relación | ||
| + | |||
| + | <center><math>\frac{c_V}{R}=\frac{c_V}{c_p-c_V}=\frac{1}{c_p/c_V-1}=\frac{1}{\gamma-1}</math></center> | ||
| + | |||
| + | que para <math>\gamma=1.4</math> da <math>c_V=2.5R</math>. | ||
| + | |||
| + | Si se quisiera hacer exactamente, habría que aplicar que para un proceso a volumen constante el calor equivale a la variación en la energía interna | ||
| + | |||
| + | <center><math>|Q_f| = |\Delta U| = U_D-U_A\,</math></center> | ||
| + | |||
| + | ====Trabajo realizado==== | ||
| + | El trabajo realizado por el sistema durante un ciclo es la diferencia entre el calor absorbido y el cedido (en valores absolutos) | ||
| + | |||
| + | <center><math>|W| = |Q_c|-|Q_f| = 13.35\,\mathrm{kJ}</math></center> | ||
| + | |||
| + | ====Rendimiento==== | ||
| + | El rendimiento de este ciclo Diesel lo podemos hallar como el trabajo realizado dividido por el calor absorbido | ||
| + | |||
| + | <center><math>\eta = \frac{|W|}{|Q_c|} = 1-\frac{|Q_f|}{|Q_c|} = 63.2\%</math></center> | ||
| + | |||
| + | Vemos que el rendimiento es mucho mayor que para un ciclo Otto que, para valores típicos de motores de explosión, rondaba el 50%. La causa principal de la diferencia es la mucho mayor relación de compresión en el motor diésel. | ||
| + | |||
| + | El rendimiento de este ciclo Diesel es, por supuesto, inferior al de un [[ciclo de Carnot]] que operara entre las temperaturas <math>T_A</math> y <math>T_C</math>: | ||
| + | |||
| + | <center><math>\eta_\mathrm{max}=1-\frac{T_A}{T_C} = 84.3\%</math></center> | ||
| + | |||
| + | ==Representación en un diagrama T-S== | ||
| + | El ciclo Otto, además de en un diagrama pV, puede reprensentarse en uno [[Diagrama T-S|T-S]], en el que el eje de abscisas corresponde a la entropía del sistema y el de ordenadas a su temperatura. | ||
| + | |||
| + | En este diagrama, los dos procesos adiabáticos corresponden a sendos segmentos verticales, pues la entropía permanece constante en un proceso adiabático reversible. | ||
| + | |||
| + | Para los procesos a volumen constante recurrimos a la expresión para la entropía de un gas ideal | ||
| + | |||
| + | <center><math>S = n c_V\ln\left(\frac{T}{T_0}\right)+n R\ln\left(\frac{V}{V_0}\right)</math></center> | ||
| + | |||
| + | siendo <math>T_0</math> y <math>V_0</math> la temperatura y el volumen de un cierto estado de referencia. Despejando de aquí la temperatura | ||
| + | |||
| + | <center><math>T=T_0 \left(\frac{V}{V_0}\right)^{\gamma-1}\mathrm{e}^{S/nc_V}</math></center> | ||
| + | |||
| + | que nos dice que cuando V es constante, la temperatura varía exponencialmente con la entropía. | ||
| + | |||
| + | El ciclo Otto corresponderá por tanto a dos curvas exponenciales conectados por dos segmentos rectilíneos. | ||
==Comparación con el ciclo Otto== | ==Comparación con el ciclo Otto== | ||
| Línea 84: | Línea 198: | ||
vemos que la eficiencia de un ciclo Diesel se diferencia de la de un ciclo Otto por el factor entre paréntesis. Este factor siempre mayor que la unidad, por ello, para iguales razones de compresión <math>r</math> | vemos que la eficiencia de un ciclo Diesel se diferencia de la de un ciclo Otto por el factor entre paréntesis. Este factor siempre mayor que la unidad, por ello, para iguales razones de compresión <math>r</math> | ||
| - | <center><math>\eta_\mathrm{Diesel} | + | <center><math>\eta_\mathrm{Diesel}<\eta_\mathrm{Otto}\,</math></center> |
[[Categoría:Segundo Principio]] | [[Categoría:Segundo Principio]] | ||
última version al 11:05 1 mar 2013
Contenido |
1 Enunciado
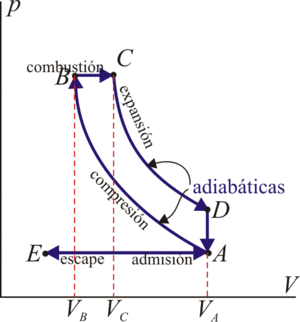
Un motor diésel puede modelarse con el ciclo ideal formado por seis pasos reversibles, según se indica en la figura. Pruebe que el rendimiento de este ciclo viene dado por la expresión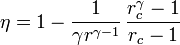
siendo r = VA / VB la razón de compresión y rc = VC / VB la relación de combustión. El método para obtener este resultado es análogo al empleado para el ciclo Otto. Compare los rendimientos del ciclo de Otto y el diésel. ¿Cuáles son las ventajas e inconvenientes respectivos?
2 Introducción
Un ciclo Diésel ideal es un modelo simplificado de lo que ocurre en un motor diésel. En un motor de esta clase, a diferencia de lo que ocurre en un motor de gasolina la combustión no se produce por la ignición de una chispa en el interior de la cámara. En su lugar, aprovechando las propiedades químicas del gasóleo, el aire es comprimido hasta una temperatura superior a la de autoignición del gasóleo y el combustible es inyectado a presión en este aire caliente, produciéndose la combustión de la mezcla.
Puesto que sólo se comprime aire, la relación de compresión (cociente entre el volumen en el punto más bajo y el más alto del pistón) puede ser mucho más alta que la de un motor de gasolina (que tiene un límite, por ser indeseable la autoignición de la mezcla). La relación de compresión de un motor diésel puede oscilar entre 12 y 24, mientras que el de gasolina puede rondar un valor de 8.
Para modelar el comportamiento del motor diésel se considera un ciclo Diesel de seis pasos, dos de los cuales se anulan mutuamente:
- Admisión E→A
- El pistón baja con la válvula de admisión abierta, aumentando la cantidad de aire en la cámara. Esto se modela como una expansión a presión constante (ya que al estar la válvula abierta la presión es igual a la exterior). En el diagrama PV aparece como una recta horizontal.
- Compresión A→B
- El pistón sube comprimiendo el aire. Dada la velocidad del proceso se supone que el aire no tiene posibilidad de intercambiar calor con el ambiente, por lo que el proceso es adiabático. Se modela como la curva adiabática reversible A→B, aunque en realidad no lo es por la presencia de factores irreversibles como la fricción.
- Combustión B→C
- Un poco antes de que el pistón llegue a su punto más alto y continuando hasta un poco después de que empiece a bajar, el inyector introduce el combustible en la cámara. Al ser de mayor duración que la combustión en el ciclo Otto, este paso se modela como una adición de calor a presión constante. Éste es el único paso en el que el ciclo Diesel se diferencia del Otto.
- Expansión C→D
- La alta temperatura del gas empuja al pistón hacia abajo, realizando trabajo sobre él. De nuevo, por ser un proceso muy rápido se aproxima por una curva adiabática reversible.
- Escape D→A y A→E
- Se abre la válvula de escape y el gas sale al exterior, empujado por el pistón a una temperatura mayor que la inicial, siendo sustituido por la misma cantidad de mezcla fría en la siguiente admisión. El sistema es realmente abierto, pues intercambia masa con el exterior. No obstante, dado que la cantidad de aire que sale y la que entra es la misma podemos, para el balance energético, suponer que es el mismo aire, que se ha enfriado. Este enfriamiento ocurre en dos fases. Cuando el pistón está en su punto más bajo, el volumen permanece aproximadamente constante y tenemos la isócora D→A. Cuando el pistón empuja el aire hacia el exterior, con la válvula abierta, empleamos la isobara A→E, cerrando el ciclo.
En total, el ciclo se compone de dos subidas y dos bajadas del pistón, razón por la que es un ciclo de cuatro tiempos, aunque este nombre se suele reservar para los motores de gasolina.
3 Rendimiento en función de las temperaturas
Un ciclo diésel contiene dos proceso adiabáticos, A→B y C→D, en los que no se intercambia calor. De los otros dos, en el calentamiento a presión constante B→C, el gas recibe una cantidad de calor | Qc | del exterior igual a
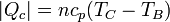
En el enfriamiento a volumen constante D→A el sistema cede una cantidad de calor al ambiente
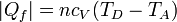
El rendimiento del ciclo será entonces
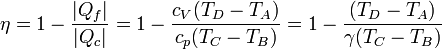
con γ = cp / cV la proporción entre las capacidades caloríficas.
4 Rendimiento en función de los volúmenes
La expresión anterior requiere conocer las cuatro temperaturas de los vértices del ciclo. Puede simplificarse teniendo en cuenta las características de cada uno de los procesos que lo componen.
Así tenemos, para la compresión adiabática A→B
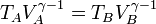
que, teniendo en cuenta la relación de compresión, podemos reescribir como
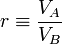

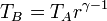
Para la expansión a presión constante, aplicando la ecuación de estado de los gases ideales
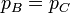

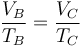
Introduciendo ahora la relación rc = VC / VB obtenemos
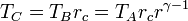
Por último, para la temperatura en D aplicamos de nuevo la ley de Poisson y el que el enfriamiento es a volumen constante:
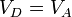
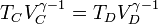

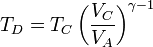
Multiplicando y dividiendo por VB y aplicando el valor de la temperatura en C
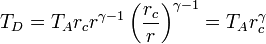
Combinado estos resultados nos queda
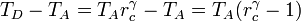
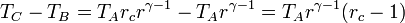
Sustituyendo esto en la expresión del rendimiento obtenemos finalmente
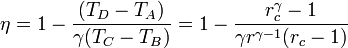
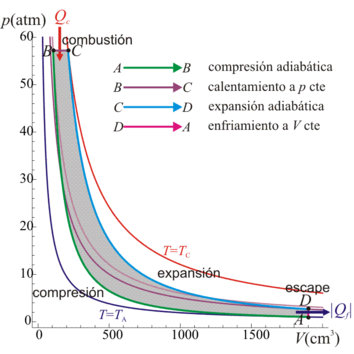
5 Caso práctico
Vamos a considerar un ciclo Diesel en la que el aire a la entrada está a una presión de 1 atm y una temperatura de 17°C; la razón de compresión es 18 y la de combustión vale 2. El volumen máximo de la cámara es de 1900 cm³. Vamos a determinar los volúmenes, presiones y temperaturas de cada vértice del ciclo, así como su rendimiento y el calor y el trabajo intercambiados por el motor.5.1 Estado inicial
Como punto de partida del ciclo de cuatro pasos tenemos que el gas a temperatura y presión ambientes llena el cilindro
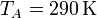
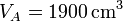
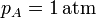
El número de moles contenidos en el cilindro es
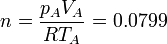
5.2 Compresión adiabática
Tras la compresión, el volumen del cilindro se reduce según la razón de compresión
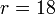

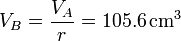
La temperatura al final la compresión la obtenemos de la ley de Poisson
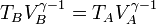

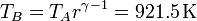
y la presión en este punto la hallamos mediante la ley de los gases ideales
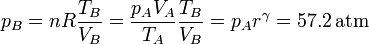
5.3 Expansión isóbara
En el proceso de calentamiento, la presión se mantiene constante, por lo que
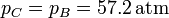
mientras que el volumen lo da la relación de combustión
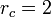

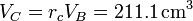
y la temperatura la ley de los gases ideales (o la ley de Charles, en este caso)
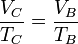

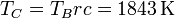
5.4 Expansión adiabática
Durante la bajada del pistón el gas se enfría adiabáticamente. La temperatura al final del proceso la da la ley de Poisson, combinada con el que sabemos que el volumen al final es el mismo que antes de empezar la compresión
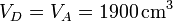
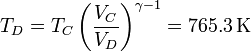
La presión en este estado es
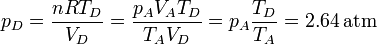
5.5 Enfriamiento a V constante
En un motor diésel real el aire quemado y caliente es expulsado por el tubo de escape, liberando calor al ambiente y siendo sustituido por nuevo aire frío. En el ciclo Diesel ideal nos imaginamos que el aire recircula, volviendo al estado A, intercambiando sólo el calor con el ambiente.
5.6 Balance energético
5.6.1 Calor absorbido
El calor procedente del foco caliente es absorbido en la expansión a presión constante y es igual a
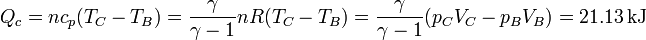
donde hemos usado que
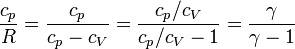
que para γ = 1.4 da el resultado conocido cp = 3.5R.
Un resultado más exacto para un proceso a presión constante, sin hacer uso de la hipótesis de gas ideal, consistiría en igualar el calor a la variación en la entalpía
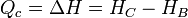
y aplicar valores tabulados de la entalpía del aire para las presiones y temperaturas de los estados B y C.
5.6.2 Calor cedido
El calor que se intercambia con el foco frío se cede en el enfriamiento a volumen constante
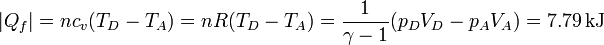
donde, como antes, hemos empleado la relación
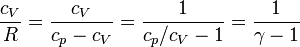
que para γ = 1.4 da cV = 2.5R.
Si se quisiera hacer exactamente, habría que aplicar que para un proceso a volumen constante el calor equivale a la variación en la energía interna
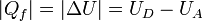
5.6.3 Trabajo realizado
El trabajo realizado por el sistema durante un ciclo es la diferencia entre el calor absorbido y el cedido (en valores absolutos)
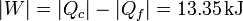
5.6.4 Rendimiento
El rendimiento de este ciclo Diesel lo podemos hallar como el trabajo realizado dividido por el calor absorbido
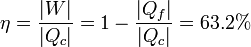
Vemos que el rendimiento es mucho mayor que para un ciclo Otto que, para valores típicos de motores de explosión, rondaba el 50%. La causa principal de la diferencia es la mucho mayor relación de compresión en el motor diésel.
El rendimiento de este ciclo Diesel es, por supuesto, inferior al de un ciclo de Carnot que operara entre las temperaturas TA y TC:
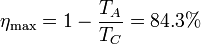
6 Representación en un diagrama T-S
El ciclo Otto, además de en un diagrama pV, puede reprensentarse en uno T-S, en el que el eje de abscisas corresponde a la entropía del sistema y el de ordenadas a su temperatura.
En este diagrama, los dos procesos adiabáticos corresponden a sendos segmentos verticales, pues la entropía permanece constante en un proceso adiabático reversible.
Para los procesos a volumen constante recurrimos a la expresión para la entropía de un gas ideal
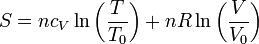
siendo T0 y V0 la temperatura y el volumen de un cierto estado de referencia. Despejando de aquí la temperatura
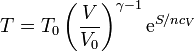
que nos dice que cuando V es constante, la temperatura varía exponencialmente con la entropía.
El ciclo Otto corresponderá por tanto a dos curvas exponenciales conectados por dos segmentos rectilíneos.
7 Comparación con el ciclo Otto
Según indicamos en la introducción, el ciclo Diesel ideal se distingue del Otto ideal en la fase de combustión, que en el ciclo Otto se supone a volumen constante y en el Diesel a presión constante. Por ello el rendimiento es diferente.
Si escribimos el rendimiento de un ciclo Diesel en la forma
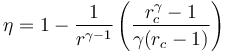
vemos que la eficiencia de un ciclo Diesel se diferencia de la de un ciclo Otto por el factor entre paréntesis. Este factor siempre mayor que la unidad, por ello, para iguales razones de compresión r