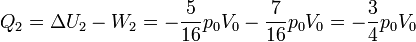Compresión lineal
De Laplace
(→Trabajo, energía y calor) |
|||
| (6 ediciones intermedias no se muestran.) | |||
| Línea 35: | Línea 35: | ||
==Trabajo, energía y calor== | ==Trabajo, energía y calor== | ||
| + | [[Archivo:diagrama-pV-lineal.png|right]] | ||
| + | |||
===Trabajo=== | ===Trabajo=== | ||
El trabajo realizado sobre el gas en un proceso reversible es igual a la integral | El trabajo realizado sobre el gas en un proceso reversible es igual a la integral | ||
| Línea 44: | Línea 46: | ||
<center><math>W= -\int_{V_0}^{V_0/2} \left(3p_0-\frac{2p_0V}{V_0}\right)\mathrm{d}V = -\left.3p_0V\right|_{V_0}^{V_0/2}+\left.\frac{p_0V^2}{V_0}\right|_{V_0}^{V_0/2} = \frac{3p_0V_0}{4}</math></center> | <center><math>W= -\int_{V_0}^{V_0/2} \left(3p_0-\frac{2p_0V}{V_0}\right)\mathrm{d}V = -\left.3p_0V\right|_{V_0}^{V_0/2}+\left.\frac{p_0V^2}{V_0}\right|_{V_0}^{V_0/2} = \frac{3p_0V_0}{4}</math></center> | ||
| - | Es muy fácil llegar a este resultado de forma gráfica, ya que el área bajo la curva es la de un trapecio de altura | + | Es muy fácil llegar a este resultado de forma gráfica, ya que el área bajo la curva es la de un trapecio de altura <math>V_0/2</math>, base menor <math>p_0</math> y base mayor <math>2p_0</math>. El área de este trapecio es |
<center><math>W = \frac{1}{2}\left(\frac{V_0}{2}\right)\left(2p_0+p_0\right) = \frac{3p_0V_0}{4}</math></center> | <center><math>W = \frac{1}{2}\left(\frac{V_0}{2}\right)\left(2p_0+p_0\right) = \frac{3p_0V_0}{4}</math></center> | ||
| + | |||
| + | ===Energía interna=== | ||
| + | Por tratarse de un gas ideal, la variación en la energía interna solo depende de la temperatura inicial y la final | ||
| + | |||
| + | <center><math>\Delta U = nc_v(T_f-T_i) = nc_v(T_0-T_0)=0\,</math></center> | ||
| + | |||
| + | Puesto que la temperatura inicial y la final son la misma, no hay variación en la energía interna del gas. | ||
| + | ===Calor=== | ||
| + | Una vez que tenemos el trabajo y la variación de la energía interna, hallamos el calor empleando el primer principio de la termodinámica | ||
| + | |||
| + | <center><math>Q = \Delta U - W = -\frac{3p_0V_0}{4}</math></center> | ||
| + | |||
| + | En este proceso se realiza trabajo, pero puesto que la temperatura del sistema es la misma al principio y al final, ese trabajo sale del sistema en forma de calor. Este proceso, no obstante, no es isotermo, ya que la temperatura del sistema cambia en los estados intermedios. | ||
| + | |||
==Temperatura máxima== | ==Temperatura máxima== | ||
| + | La temperatura del gas en cada estado del proceso la hallamos por la ley de los gases ideales | ||
| + | |||
| + | <center><math>T(V) = \frac{p(V)V}{n R} = \frac{3p_0V-2p_0V^2/V_0}{p_0V_0/T_0}=\frac{3T_0V}{V_0}-2\frac{2T_0V^2}{V_0^2}</math></center> | ||
| + | |||
| + | La gráfica de esta función tiene una forma parabólica, con un máximo en algún punto intermedio entre el estado inicial y el final. Hallamos la posición del máximo igualando la derivada a cero. | ||
| + | |||
| + | <center><math>0 = \frac{\mathrm{d}T}{\mathrm{d}V}=\frac{3T_0}{V_0}-\frac{4T_0V}{V_0^2}</math>{{tose}}<math>V = \frac{3V_0}{4}</math></center> | ||
| + | |||
| + | Este volumen corresponde al punto medio entre el estado inicial y el final. La temperatura en este punto es | ||
| + | |||
| + | <center><math>T_\mathrm{max}=\frac{3T_0}{V_0}\left(\frac{3V_0}{4}\right)-\frac{2T_0}{V_0^2}\left(\frac{3V_0}{4}\right)^2 = \frac{9}{8}T_0</math></center> | ||
| + | |||
| + | La temperatura del gas, por tanto, aumenta desde <math>T_0</math> a (9/8) de este valor y a partir de ahí vuelve a disminuir al valor inicial | ||
| + | |||
==División en dos tramos== | ==División en dos tramos== | ||
| + | De acuerdo con el resultado del apartado anterior, cuando se comprime el gas entre <math>V_0</math> y <math>3V_0/4</math>, la temperatura aumenta, disminuyendo entre ese valor y <math>V_0/2</math>. Si consideramos los dos procesos por separado obtenemos los resultados siguientes: | ||
| + | |||
| + | ===Trabajo=== | ||
| + | ====Primer tramo==== | ||
| + | Hallamos el trabajo empleando de nuevo la fórmula del trapecio (o la integral, que es equivalente). Este trapecio tiene altura <math>V_0/4</math> y bases <math>p_0</math> y <math>3p_0/2</math> | ||
| + | |||
| + | <center><math>W_1 = \frac{1}{2}\left(\frac{V_0}{4}\right)\left(\frac{3p_0}{2}+p_0\right) = \frac{5}{16}p_0V_0</math></center> | ||
| + | ====Segundo tramo==== | ||
| + | Para la segunda parte del trayecto podemos hallar el trabajo como el área de un nuevo trapecio o considerando que es el trabajo restante hasta completar el total. En cualquier caso, el resultado es | ||
| + | |||
| + | <center><math>W_2 = W - W_1 = \frac{3p_0V_0}{4}-\frac{5p_0V_0}{16} = \frac{7}{16}p_0V_0</math></center> | ||
| + | ===Energía=== | ||
| + | Los dos tramos no son isotermos, ya que la temperatura primero sube y luego baja, por lo que hay variación en la energía interna en cada uno dellos. | ||
| + | |||
| + | ====Primer tramo==== | ||
| + | Por tratarse de un gas ideal diatómico, la variación de energía es | ||
| + | |||
| + | <center><math>\Delta U_1 =nc_v(T_1-T_0) =\frac{5}{2}nR\left(\frac{9}{8}T_0-T_0\right)=\frac{5}{16}nRT_0=\frac{5}{16}p_0V_0</math></center> | ||
| + | |||
| + | ====Segundo tramo==== | ||
| + | Operando del mismo modo | ||
| + | |||
| + | <center><math>\Delta U_2 =\frac{5}{2}nR\left(T_0-\frac{9}{8}T_0-T_0\right)=-\frac{5}{16}p_0V_0</math></center> | ||
| + | |||
| + | Resulta igual y de signo contrario a la anterior, como corresponde a que la variación neta de energía es nula. | ||
| + | |||
| + | ===Calor=== | ||
| + | Para calcular el calor en cada tramo del proceso aplicamos el primer principio de la termodinámica | ||
| + | ====Primer tramo==== | ||
| + | El calor en este proceso es | ||
| + | |||
| + | <center><math>Q_1 = \Delta U_1 - W_1 = \frac{5}{16}p_0V_0-\frac{5}{16}p_0V_0 = 0</math></center> | ||
| + | |||
| + | Este proceso es globalmente adiabático, aunque en pasos intermedios se intercambie calor con el entorno. | ||
| + | |||
| + | ====Segundo tramo==== | ||
| + | El calor en este parte se halla de la misma forma | ||
| + | |||
| + | <center><math>Q_2 = \Delta U_2 - W_2 = -\frac{5}{16}p_0V_0-\frac{7}{16}p_0V_0 = -\frac{3}{4}p_0V_0</math></center> | ||
| + | |||
| + | |||
| + | |||
| + | |||
[[Categoría:Problemas del gas ideal]] | [[Categoría:Problemas del gas ideal]] | ||
última version al 18:02 16 nov 2010
Contenido |
1 Enunciado
Se tiene un volumen V0 de un gas ideal diatómico a una presión p0 y una temperatura T0 encerrado en un recipiente con un pistón móvil. Este gas se comprime reversiblemente según la ley
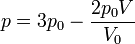
reduciéndose el volumen hasta V0 / 2.
- Trace la gráfica del proceso en un diagrama PV.
- Calcule la temperatura final del proceso.
- Calcule el trabajo neto realizado sobre el gas, la variación de su energía interna y el calor que entra en el gas durante el proceso.
- ¿Para qué volumen durante el proceso la temperatura es máxima? Halle el valor de esta temperatura máxima.
- Separando el proceso en dos: uno hasta que alcanza la temperatura máxima y otro de ahí hasta el final, halle W, ΔU y Q en cada uno de los dos subprocesos.
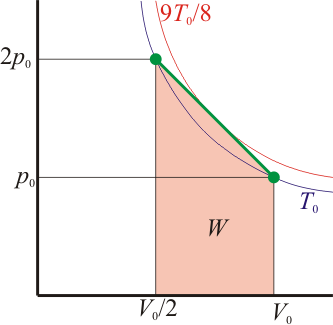
2 Representación gráfica
Dado que la presión depende del volumen en la forma
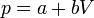
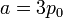

es claro que la gráfica del proceso es un segmento rectilíneo. El punto inicial del segmento es (p0,V0) y el punto final corresponde a V = V0 / 2 y a la presión
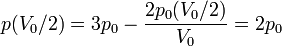
Por tanto el volumen final es la mitad del inicial, mientras que la presión es el doble.
3 Temperatura final
Obtenemos la temperatura final a partir de la ecuación de los gases ideales. Inicialmente tenemos
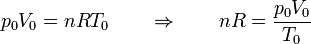
En el estado final
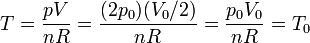
Por tanto, la temperatura final es igual a la inicial.
4 Trabajo, energía y calor
4.1 Trabajo
El trabajo realizado sobre el gas en un proceso reversible es igual a la integral
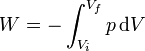
En nuestro caso
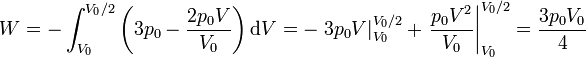
Es muy fácil llegar a este resultado de forma gráfica, ya que el área bajo la curva es la de un trapecio de altura V0 / 2, base menor p0 y base mayor 2p0. El área de este trapecio es
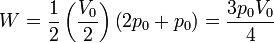
4.2 Energía interna
Por tratarse de un gas ideal, la variación en la energía interna solo depende de la temperatura inicial y la final
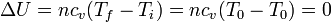
Puesto que la temperatura inicial y la final son la misma, no hay variación en la energía interna del gas.
4.3 Calor
Una vez que tenemos el trabajo y la variación de la energía interna, hallamos el calor empleando el primer principio de la termodinámica
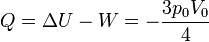
En este proceso se realiza trabajo, pero puesto que la temperatura del sistema es la misma al principio y al final, ese trabajo sale del sistema en forma de calor. Este proceso, no obstante, no es isotermo, ya que la temperatura del sistema cambia en los estados intermedios.
5 Temperatura máxima
La temperatura del gas en cada estado del proceso la hallamos por la ley de los gases ideales
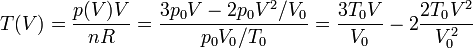
La gráfica de esta función tiene una forma parabólica, con un máximo en algún punto intermedio entre el estado inicial y el final. Hallamos la posición del máximo igualando la derivada a cero.
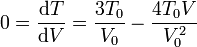

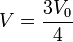
Este volumen corresponde al punto medio entre el estado inicial y el final. La temperatura en este punto es

La temperatura del gas, por tanto, aumenta desde T0 a (9/8) de este valor y a partir de ahí vuelve a disminuir al valor inicial
6 División en dos tramos
De acuerdo con el resultado del apartado anterior, cuando se comprime el gas entre V0 y 3V0 / 4, la temperatura aumenta, disminuyendo entre ese valor y V0 / 2. Si consideramos los dos procesos por separado obtenemos los resultados siguientes:
6.1 Trabajo
6.1.1 Primer tramo
Hallamos el trabajo empleando de nuevo la fórmula del trapecio (o la integral, que es equivalente). Este trapecio tiene altura V0 / 4 y bases p0 y 3p0 / 2
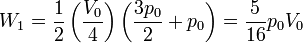
6.1.2 Segundo tramo
Para la segunda parte del trayecto podemos hallar el trabajo como el área de un nuevo trapecio o considerando que es el trabajo restante hasta completar el total. En cualquier caso, el resultado es
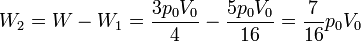
6.2 Energía
Los dos tramos no son isotermos, ya que la temperatura primero sube y luego baja, por lo que hay variación en la energía interna en cada uno dellos.
6.2.1 Primer tramo
Por tratarse de un gas ideal diatómico, la variación de energía es
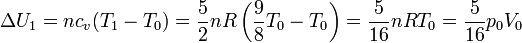
6.2.2 Segundo tramo
Operando del mismo modo
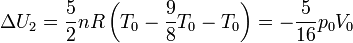
Resulta igual y de signo contrario a la anterior, como corresponde a que la variación neta de energía es nula.
6.3 Calor
Para calcular el calor en cada tramo del proceso aplicamos el primer principio de la termodinámica
6.3.1 Primer tramo
El calor en este proceso es

Este proceso es globalmente adiabático, aunque en pasos intermedios se intercambie calor con el entorno.
6.3.2 Segundo tramo
El calor en este parte se halla de la misma forma