Inmersión de un bloque metálico en agua
De Laplace
(→Temperatura final) |
|||
| Línea 15: | Línea 15: | ||
Sustituyendo | Sustituyendo | ||
| - | <center><math>50000\,\mathrm{g}\left(0.095\,\frac{\mathrm{cal}}{\mathrm{g}\cdot^\circ\mathrm{C}}\right)(60^\circ\mathrm{C}-t) = 120000\,\mathrm{g}\left( | + | <center><math>50000\,\mathrm{g}\left(0.095\,\frac{\mathrm{cal}}{\mathrm{g}\cdot^\circ\mathrm{C}}\right)(60^\circ\mathrm{C}-t) = 120000\,\mathrm{g}\left(1,\frac{\mathrm{cal}}{\mathrm{g}\cdot^\circ\mathrm{C}}\right)(t-25^\circ\mathrm{C})</math></center> |
que tiene por solución | que tiene por solución | ||
| Línea 22: | Línea 22: | ||
==Variación de la entropía== | ==Variación de la entropía== | ||
| + | ===Del cobre=== | ||
| + | Al enfriarse, la entropía del cobre disminuye. Si el calor específico puede suponerse independiente de la temperatura, la variación de entropía es igual a | ||
| + | |||
| + | <center><math>\Delta S_\mathrm{Cu}=\int_{T_1}^{T_2} \frac{\mathrm{d}Q_\mathrm{rev}}{T}=m_\mathrm{Cu}c_\mathrm{Cu}\int_{T_1}^{T_2} \frac{\mathrm{d}T}{T} = mc_p\ln\left(\frac{T_2}{T_1}\right)</math></center> | ||
| + | |||
| + | siendo su valor numérico | ||
| + | |||
| + | <center><math>\Delta S_\mathrm{Cu}=50000\,\mathrm{g}\left(0.095\,\frac{\mathrm{cal}}{\mathrm{g}\cdot^\circ\mathrm{C}}\right)\ln\left(\frac{273.15+26.3}{273.15+80.0}\right)=-506\,\frac{\mathrm{cal}}{^\circ\mathrm{C}}= -2.1\,\frac{\mathrm{kJ}}{\mathrm{K}}</math></center> | ||
| + | |||
| + | ===Del agua=== | ||
| + | El agua se calienta, por lo que su entropía aumenta. Suponiendo de nuevo que el calor específico puede suponerse independiente de la temperatura (lo cual es muy razonable dado que el agua se calienta menos de 2 grados), la variación de entropía es | ||
| + | |||
| + | <center><math>\Delta S_\mathrm{H_2O}=m_\mathrm{H_2O}c_\mathrm{H_2O}\ln\left(\frac{T_2}{T_1}\right)</math></center> | ||
| + | |||
| + | siendo su valor numérico | ||
| + | |||
| + | <center><math>\Delta S_\mathrm{H_2O}=120000\,\mathrm{g}\left(1,\frac{\mathrm{cal}}{\mathrm{g}\cdot^\circ\mathrm{C}}\right)\ln\left(\frac{273.15+26.3}{273.15+25.0}\right)=+535\,\frac{\mathrm{cal}}{^\circ\mathrm{C}}= +2.2\,\frac{\mathrm{kJ}}{\mathrm{K}}</math></center> | ||
| + | |||
| + | ===Total=== | ||
| + | Sumando los dos incrementos obtenemos la variación de entropía total | ||
| + | |||
| + | <center><math>\Delta S=\Delta S_\mathrm{Cu}+\Delta S_\mathrm{H_2O} = -506\,\frac{\mathrm{cal}}{^\circ\mathrm{C}}+ 535\,\frac{\mathrm{cal}}{^\circ\mathrm{C}}= 29\,\frac{\mathrm{cal}}{^\circ\mathrm{C}} = 122\,\frac{\mathrm{J}}{\mathrm{K}}</math></center> | ||
| + | |||
[[Categoría:Problemas del segundo principio de la termodinámica]] | [[Categoría:Problemas del segundo principio de la termodinámica]] | ||
Revisión de 14:03 30 abr 2009
Contenido |
1 Enunciado
Un bloque de cobre de 50 kg a 80°C se deja caer en un tanque aislado adiabáticamente que contiene 120 l de agua a 25°C. Determine la temperatura final de equilibrio y la variación total del entropía.
Dato: cp(cobre) = 0.095 cal/g·°C.
2 Temperatura final
Al sumergirse, el cobre se enfría, cediendo calor al agua, que se calienta. El equilibrio se alcanza cuando ambos se ponen la misma temperatura.
La temperatura de equilibrio la obtenemos igualando el calor cedido por el cobre con el absorbido por el agua
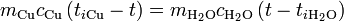
Sustituyendo

que tiene por solución
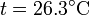
3 Variación de la entropía
3.1 Del cobre
Al enfriarse, la entropía del cobre disminuye. Si el calor específico puede suponerse independiente de la temperatura, la variación de entropía es igual a
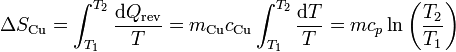
siendo su valor numérico

3.2 Del agua
El agua se calienta, por lo que su entropía aumenta. Suponiendo de nuevo que el calor específico puede suponerse independiente de la temperatura (lo cual es muy razonable dado que el agua se calienta menos de 2 grados), la variación de entropía es
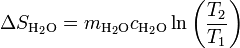
siendo su valor numérico

3.3 Total
Sumando los dos incrementos obtenemos la variación de entropía total






