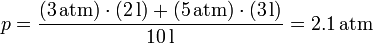Presión en una mezcla de gases
De Laplace
(Diferencias entre revisiones)
(→Solución) |
(→Solución) |
||
| Línea 11: | Línea 11: | ||
y la presión total | y la presión total | ||
| - | <center><math>p = p_A + p_B | + | <center><math>p = p_A + p_B = \frac{p_{A0}V_{A0}+p_{B0}V_{B0}}{V_f}</math></center> |
Sustituyendo los valores numéricos | Sustituyendo los valores numéricos | ||
última version al 21:16 27 abr 2009
1 Enunciado
En un frasco de 10 litros se mezclan 2 litros del gas A a 3 atmósferas de presión y 3 litros del gas B a 5 atmósferas. Admitiendo que los gases son ideales e inertes, ¿cuál será la presión final si la temperatura permanece constante en todo el proceso?
2 Solución
La presión de la mezcla será la suma de las presiones parciales, esto es, la suma de las presiones que habría si estuviera únicamente uno de los gases en el recipiente.
Para cada uno de los gases se cumplirá la ley de Boyle
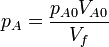
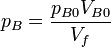
y la presión total
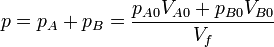
Sustituyendo los valores numéricos