Modelo de atmósfera isoterma
De Laplace
(→Introducción) |
(→Introducción) |
||
| Línea 12: | Línea 12: | ||
<center><math>pV = n R T\,</math></center> | <center><math>pV = n R T\,</math></center> | ||
| - | + | <math>R</math> es la constante de los gases ideales y la cantidad <math>n</math> es el número de moles, que será igual a la masa total del gas que tengamos, dividida por su peso molecular, esto es | |
| - | <center><math>p V = \frac{m}{P_m}RT</math> {{tose}}<math>p = \frac{RT}{P_m}\,\frac{m}{V}=\frac{RT}{P_m}\rho</math></center> | + | <center><math>p V = \frac{m}{P_m}RT</math>{{tose}}<math>p = \frac{RT}{P_m}\,\frac{m}{V}=\frac{RT}{P_m}\rho</math></center> |
Si la temperatura del gas es la misma en todos los puntos, la presión es proporcional a la densidad, pero si varía, habrá que tenerlo en cuenta. La hipótesis de partida habrá dejado de ser cierta. | Si la temperatura del gas es la misma en todos los puntos, la presión es proporcional a la densidad, pero si varía, habrá que tenerlo en cuenta. La hipótesis de partida habrá dejado de ser cierta. | ||
| Línea 22: | Línea 22: | ||
<center><math>\frac{\rho T}{p}= \frac{\rho_0 T_0}{p_0}=\frac{P_m}{R}=\mathrm{cte}</math></center> | <center><math>\frac{\rho T}{p}= \frac{\rho_0 T_0}{p_0}=\frac{P_m}{R}=\mathrm{cte}</math></center> | ||
| - | y | + | siendo <math>p_0</math>, <math>\rho_0</math> y <math>T_0</math> la presión densidad y temperatura en un punto concreto. De aquí |
<center><math>\rho = \rho_0\left(\frac(T}{T_0}\right)\left(\frac(p}{p_0}\right)</math></center> | <center><math>\rho = \rho_0\left(\frac(T}{T_0}\right)\left(\frac(p}{p_0}\right)</math></center> | ||
Revisión de 19:20 13 mar 2009
Contenido |
1 Enunciado
Suponiendo que la densidad del aire en la atmósfera es proporcional a la presión, demuestre que la variación de la presión atmosférica con la altura es P(y) = P0e − y, siendo g la aceleración de la gravedad y α = ρ0g / P0, con ρ0 y P0 la densidad del aire y la presión atmosférica a nivel del mar (y = 0).
2 Solución
2.1 Introducción
Antes de resolver el problema, es conveniente aclarar la razón de la palabra "isoterma" del título. Puede parecer incongruente, dado que en el enunciado del problema no se hace mención alguna a la temperatura.
La causa es la frase “Suponiendo que la densidad del aire en la atmósfera es proporcional a la presión”.
¿Por qué es razonable hacer esta hipótesis? Para entenderlo, observamos que el aire se comporta aproximadamente como un gas ideal. Para un gas ideal, se cumple la ecuación de estado
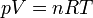
R es la constante de los gases ideales y la cantidad n es el número de moles, que será igual a la masa total del gas que tengamos, dividida por su peso molecular, esto es
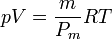

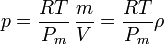
Si la temperatura del gas es la misma en todos los puntos, la presión es proporcional a la densidad, pero si varía, habrá que tenerlo en cuenta. La hipótesis de partida habrá dejado de ser cierta.
Para evitar usar el peso molecular, que para el aire es simplemente un promedio (pues se trata de una mezcla de gases), podemos escribir la ecuación anterior como
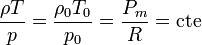
siendo p0, ρ0 y T0 la presión densidad y temperatura en un punto concreto. De aquí
si la temperatura es la misma en todos los puntos

Esta es la hipótesis que haremos en el siguiente apartado. Más adelante veremos como queda si suponemos una temperatura que varía con la altura.





