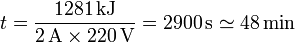Calentamiento de agua con una resistencia
De Laplace
(→Calor) |
|||
| (2 ediciones intermedias no se muestran.) | |||
| Línea 10: | Línea 10: | ||
Al ser el émbolo móvil, todos los procesos son a presión exterior constante. Suponiendo que ocurre cuasiestáticamente, esta presión será también la interior. | Al ser el émbolo móvil, todos los procesos son a presión exterior constante. Suponiendo que ocurre cuasiestáticamente, esta presión será también la interior. | ||
| - | Para vaporizar el agua primero hay que llevarla a 100°C, lo que requiere una cantidad calor | + | Para vaporizar el agua primero hay que llevarla a 100°C, lo que requiere una cantidad de calor |
<center><math>Q_1 = 0.500\,\mathrm{kg}\cdot4.18\frac{\mathrm{kJ}}{\mathrm{kg}\cdot\mathrm{K}}\times 73\,\mathrm{K} = 153\,\mathrm{kJ}</math></center> | <center><math>Q_1 = 0.500\,\mathrm{kg}\cdot4.18\frac{\mathrm{kJ}}{\mathrm{kg}\cdot\mathrm{K}}\times 73\,\mathrm{K} = 153\,\mathrm{kJ}</math></center> | ||
| Línea 36: | Línea 36: | ||
<center><math>V_2 = \frac{0.50\times 8.314\times 373}{0.018\times 10^5}\,\mathrm{m}^3 = 0.861\,\mathrm{m}^3</math></center> | <center><math>V_2 = \frac{0.50\times 8.314\times 373}{0.018\times 10^5}\,\mathrm{m}^3 = 0.861\,\mathrm{m}^3</math></center> | ||
| + | |||
| + | Vemos que volumen se multiplica por 1700, y para ocupar todo ese espacio con vapor, es necesario desalojar la cantidad correspondiente de aire, venciendo a la presión externa. | ||
| + | |||
| + | El trabajo realizado sobre el gas (de signo contrario al realizado por el gas) es igual a la presión (constante) multiplicada por el incremento de volumen | ||
| + | |||
| + | <center><math>W=-p\,\Delta V = -10^5(0.861-0.0005)\,\mathrm{J} = -86.1\,\mathrm{kJ}</math></center> | ||
| + | |||
| + | Vemos que el volumen inicial es absolutamente despreciable comparado con el final. | ||
| + | |||
==Entalpía y energía== | ==Entalpía y energía== | ||
| + | En un proceso a presión constante, el calor que entra en el sistema es igual al incremento de entalpía, por lo que | ||
| + | |||
| + | <center><math>\Delta H = Q = 1281\,\mathrm{kJ}</math></center> | ||
| + | |||
| + | mientras que el aumento de la energía interna lo hallamos sumando el calor y el trabajo | ||
| + | |||
| + | <center><math>\Delta U = Q + W = 1281\,\mathrm{kJ}-86.1\,\mathrm{kJ} = 1195\,\mathrm{kJ}</math></center> | ||
| + | |||
| + | Debido a que parte del calor se emplea en realizar trabajo, el incremento de energía interna no es el máximo posible. | ||
| + | |||
==Tiempo necesario== | ==Tiempo necesario== | ||
| + | Cuando tenemos una resistencia eléctrica, esta realiza un trabajo en un tiempo <math>\mathrm{d}t</math> | ||
| + | |||
| + | <center><math>\delta W_e = I\ \Delta V\,\mathrm{d}t</math></center> | ||
| + | |||
| + | donde aquí <math>\Delta V</math> es el voltaje o diferencia de potencial eléctrico entre los extremos de la resistencia. Este trabajo eléctrico se transmite al gas en forma de calor, con lo que en el émbolo entra un calor | ||
| + | |||
| + | <center><math>\Delta Q = I\,\Delta V\,\mathrm{d}t</math></center> | ||
| + | |||
| + | Si la tensión y el voltaje son constantes, el calor que entra en un tiempo <math>t</math> es simplemente | ||
| + | |||
| + | <center><math>Q = I\,\Delta V\, t</math></center> | ||
| + | |||
| + | con lo cual el tiempo necesario para que entre una cantidad de calor dada se halla simplemente despejando | ||
| + | |||
| + | <center><math>t = \frac{Q}{I\,\Delta V}</math></center> | ||
| + | |||
| + | En nuestro caso particular | ||
| + | |||
| + | <center><math>t = \frac{1281\,\mathrm{kJ}}{2\,\mathrm{A}\times 220\,\mathrm{V}}= 2900\,\mathrm{s}\simeq 48\,\mathrm{min}</math></center> | ||
[[Categoría:Problemas del primer principio de la termodinámica (GIE)]] | [[Categoría:Problemas del primer principio de la termodinámica (GIE)]] | ||
última version al 14:27 1 abr 2015
Contenido |
1 Enunciado
En una cámara con un émbolo móvil se coloca 500 cm³ de agua a 300 K. El exterior se encuentra a una presión de 100 kPa. Se le comunica lentamente calor al agua hasta que se evapora por completo.
- Calcule el calor necesario para que se realice este proceso.
- Halle el trabajo que se realiza sobre el agua.
- Calcule la variación en la entalpía y en la energía interna del agua.
- Suponga que el calentamiento se produce mediante una resistencia eléctrica a una tensión de 220 V por la que pasa una corriente de 2 A. ¿Cuánto tiempo tarda en realizarse el proceso? En este caso, la energía entra en el sistema en forma de calor o de trabajo?
2 Calor
Al ser el émbolo móvil, todos los procesos son a presión exterior constante. Suponiendo que ocurre cuasiestáticamente, esta presión será también la interior.
Para vaporizar el agua primero hay que llevarla a 100°C, lo que requiere una cantidad de calor
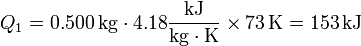
A continuación hay que comunicarle el calor necesario para evaporar el agua

El calor total necesario será la suma de estos dos

3 Trabajo
El sistema realiza trabajo ya que se produce un incremento de volumen, pues el vapor ocupa mucho más espacio que el agua líquida.
Inicialmente el sistema ocupa
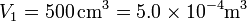
y tras la evaporación, suponiendo que se comporta como un gas ideal
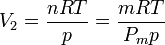
Sustituyendo los valores numéricos
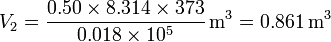
Vemos que volumen se multiplica por 1700, y para ocupar todo ese espacio con vapor, es necesario desalojar la cantidad correspondiente de aire, venciendo a la presión externa.
El trabajo realizado sobre el gas (de signo contrario al realizado por el gas) es igual a la presión (constante) multiplicada por el incremento de volumen

Vemos que el volumen inicial es absolutamente despreciable comparado con el final.
4 Entalpía y energía
En un proceso a presión constante, el calor que entra en el sistema es igual al incremento de entalpía, por lo que
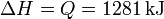
mientras que el aumento de la energía interna lo hallamos sumando el calor y el trabajo
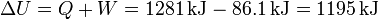
Debido a que parte del calor se emplea en realizar trabajo, el incremento de energía interna no es el máximo posible.
5 Tiempo necesario
Cuando tenemos una resistencia eléctrica, esta realiza un trabajo en un tiempo dt
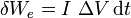
donde aquí ΔV es el voltaje o diferencia de potencial eléctrico entre los extremos de la resistencia. Este trabajo eléctrico se transmite al gas en forma de calor, con lo que en el émbolo entra un calor
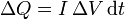
Si la tensión y el voltaje son constantes, el calor que entra en un tiempo t es simplemente
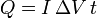
con lo cual el tiempo necesario para que entre una cantidad de calor dada se halla simplemente despejando
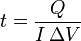
En nuestro caso particular