Electrostática en presencia de dieléctricos (GIE)
De Laplace
(→Concepto de dieléctrico) |
(→Concepto de dieléctrico) |
||
| Línea 28: | Línea 28: | ||
:En una molécula de agua, el oxígeno tira de los electrones con más fuerza que los átomos de hidrógeno, de forma que en la molécula aparece una densidad de carga negativa en la parte donde se encuentra el oxígeno y positiva en el lado opuesto. La molécula se comporta como un dipolo. Esto no ocurre en todas las sustancias. El dióxido de carbono, por ejemplo, es una sustancia apolar, aunque el oxígeno tira más de los electrones que el carbono, la simetría de la molécula evita que se produzca separación de los centros de carga. | :En una molécula de agua, el oxígeno tira de los electrones con más fuerza que los átomos de hidrógeno, de forma que en la molécula aparece una densidad de carga negativa en la parte donde se encuentra el oxígeno y positiva en el lado opuesto. La molécula se comporta como un dipolo. Esto no ocurre en todas las sustancias. El dióxido de carbono, por ejemplo, es una sustancia apolar, aunque el oxígeno tira más de los electrones que el carbono, la simetría de la molécula evita que se produzca separación de los centros de carga. | ||
| - | <center>[[Archivo:molecula-dioxido-carbono. | + | <center>[[Archivo:molecula-dioxido-carbono.png]]</center> |
==Permitividad== | ==Permitividad== | ||
Revisión de 10:13 7 jun 2012
Contenido |
1 Concepto de dieléctrico
Los medios materiales responden de diferentes maneras en presencia de un campo eléctrico aplicado. Un material Electrostática_en_presencia_de_conductores_(GIE) es aquel que permite el movimiento de cargas por su interior, llegando finalmente al estado de equilibrio electrostático.
Los dieléctricos o aislantes son aquellos materiales que no permiten el movimiento de cargas por su interior. En ellos todas las cargas están ligadas en sus respectivos átomos y no pueden desplazarse. Suelen ser materiales plásticos o cristalinos con fuertes enlaces covalentes. Incluso en materiales dieléctricos el campo no es el mismo que en el vacío, por la presencia de dipolos inducidos por el campo eléctrico. El límite es el modelo de dieléctrico ideal o aislante perfecto, que no permite en absoluto el movimiento de cargas por su interior.
El efecto de una conductividad finita en un dieléctrico real se analiza al estudiar las corrientes eléctricas. Aquí consideramos el modelo más simple de un dieléctrico ideal.
Podemos preguntarnos, si un dieléctrico ideal no permite el movimiento de cargas y éstas no pueden redistribuirse por el material, ¿cómo influye en el campo eléctrico? ¿Por qué no es equivalente al vacío?
La respuesta es que aunque un dieléctrico ideal no tenga cargas libres, sí tiene dipolos. Un dipolo eléctrico consiste en un par de cargas de la misma magnitud y signo opuesto separadas una cierta distancia. Un dipolo produce un campo eléctrico característico.
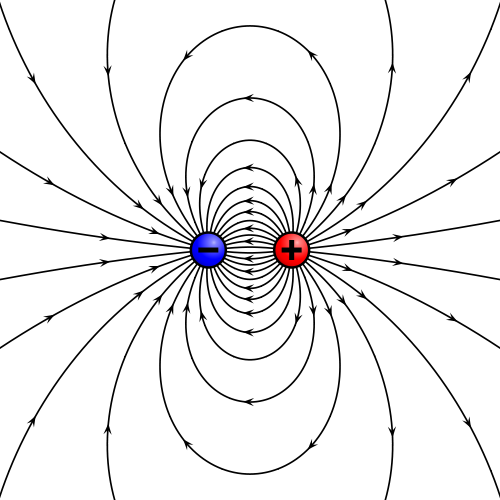
En un dipolo las cargas no son libres, sino que están ligadas entre sí, pero sus campos no se neutralizan por estar separadas. Un dieléctrico ideal está constituido por millones de dipolos elementales, que afectan al campo eléctrico.
¿De dónde proceden estos dipolos? Hay de dos tipos, no excluyentes:
- Dipolos inducidos
- Son los que aparecen por la aplicación de un campo eléctrico. Consideremos, por ejemplo, átomo de helio, formado por un núcleo de carga positiva rodeado de una nube de carga negativa. En ausencia de campo externo el núcleo se encuentra en el centro de la nube negativa y no hay separación de los centros de carga.

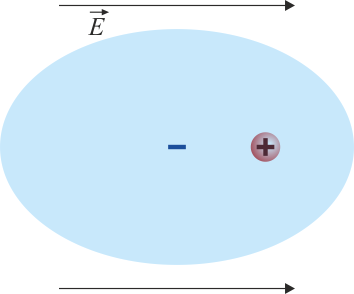
- Si se aplica un campo externo, el núcleo es empujado en el sentido del campo, mientras que la nube es empujada en el sentido opuesto. El resultado es una separación de los centros de carga, formándose un dipolo. Nótese que las cargas son ligadas y en ningún momento llega a arrancarse un electrón del átomo.
- Dipolos permanentes
- Las llamadas sustancias polares, como el agua, están formadas por moléculas que ya de por sí son dipolos.
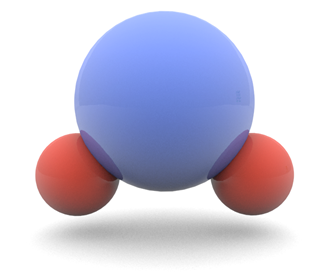
- En una molécula de agua, el oxígeno tira de los electrones con más fuerza que los átomos de hidrógeno, de forma que en la molécula aparece una densidad de carga negativa en la parte donde se encuentra el oxígeno y positiva en el lado opuesto. La molécula se comporta como un dipolo. Esto no ocurre en todas las sustancias. El dióxido de carbono, por ejemplo, es una sustancia apolar, aunque el oxígeno tira más de los electrones que el carbono, la simetría de la molécula evita que se produzca separación de los centros de carga.






