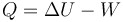Sucesión de tres procesos cuasiestáticos
De Laplace
| Línea 99: | Línea 99: | ||
El signo del trabajo nos dice que en realidad es el gas el que realiza el trabajo sobre el ambiente. | El signo del trabajo nos dice que en realidad es el gas el que realiza el trabajo sobre el ambiente. | ||
==Energía y calor== | ==Energía y calor== | ||
| + | La energía interna de un gas ideal depende solamente de su temperatura | ||
| + | |||
| + | <center><math>U = U_0 + n c_v T\,</math></center> | ||
| + | |||
| + | siendo la capacidad calorífica molar para el aire aproximadamente igual a la de un gas diatómico | ||
| + | |||
| + | <center><math>c_v = \frac{5}{2}R = 20.8\frac{\mathrm{J}}{\mathrm{K}\cdot\mathrm{mol}}</math></center> | ||
| + | |||
| + | La variación de la energía interna en cualquier proceso es proporcional a la diferencia de temperaturas | ||
| + | |||
| + | <center><math>\Delta U = nc_v\,\Delta T</math></center> | ||
| + | |||
| + | independientemente de si el proceso es a presión constante, a volumen constante o como sea, por tratarse de una función de estado. | ||
| + | |||
| + | Una vez que calculemos la variación en la energía, podemos hallar el calor que entra en el gas por el primer principio de la termodinámica | ||
| + | |||
| + | <center><math>Q = \Delta U - W\,</math></center> | ||
[[Categoría:Problemas del primer principio de la termodinámica (GIE)]] | [[Categoría:Problemas del primer principio de la termodinámica (GIE)]] | ||
Revisión de 18:57 1 mar 2012
Contenido |
1 Enunciado
Un cilindro de 20 cm de diámetro contiene aire y está cerrado por un émbolo. Inicialmente el aire tiene una temperatura de 27 °C y una presión de 100 kPa, que también es la presión exterior, estando el émbolo a 10 cm del fondo. Entonces se realiza el siguiente proceso cuasiestático
- I: Se atornilla el émbolo y se calienta el aire hasta 327 °C, sumergiéndolo en un baño a esta temperatura.
- II: Se libera el émbolo lentamente, dejando que se expanda el aire hasta que su presión vuelve a ser la inicial. En este proceso el aire se mantiene a la temperatura de 327 °C.
- III: Con el émbolo libre, se enfría gradualmente hasta que la temperatura vuelve a ser la inicial.
Para este proceso:
- Halle la presión, volumen y temperatura al final de cada fase del proceso.
- Calcule el trabajo en cada fase, así como el trabajo neto total.
- Calcule la variación en la energía interna y el calor en cada paso y su variación neta.
2 Presión, volumen y temperatura
2.1 Estado inicial
Inicialmente tenemos que la presión y la temperatura valen

mientras que el volumen es el de un cilindro

2.2 Tras el primer paso
El primer paso ocurre a volumen constante, por estar el pistón atornillado, con lo que el voluemn final es el mismo que el inicial
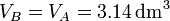
La temperatura ha aumentado en 300°C
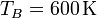
y la presión aumenta en la misma proporción que la temperatura
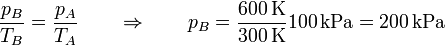
2.3 Tras el segundo paso
En el segundo paso tenemos una expansión isoterma, siendo la temperatura final igual a la que había al final del paso anterior
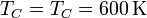
mientras que la presión final vuelve a ser la que había al principio
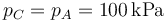
El volumen final lo podemos obtener particularizando la ley d elos gases ideales para temperatura constante, es decir, aplicando la ley de Boyle

2.4 Estado final
Por último, dejando el émbolo libre, la temperatura vuelve a ser la inicial, manteniéndose constante la presión
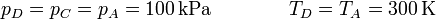
La ley de los gases ideales se reduce en este caso a la ley de Charles

Al ser la presión y la temperatura finales iguales a las de partida también lo es el volumen. El estado D es el mismo que el estado A y el proceso es por tanto un ciclo.
2.5 Representación gráfica
Gráficamente este proceso se compone de tres tramos:
- Un calentamiento a volumen constante, que corresponde a una recta vertical.
- Una expansión isoterma, que se representa por un arco de hipérbola.
- Una compresión a presión constante, que en la gráfica queda como una recta horizontal.
3 Trabajo
Podemos hallar el trabajo sobre el gas en cada paso a partir de la evolución de sus variables de estado, si suponemos que todos los procesos son cuasiestáticos.
3.1 Calentamiento a volumen constante
Al permanecer constante el volumen, no se realiza trabajo sobre el gas

3.2 Expansión isoterma
Cuando la temperatura permanece constante, podemos calcular el trabajo con ayuda de la ecuación de estado de la ley de Boyle. En cualquier punto del camino
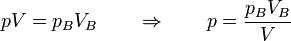
lo que nos da el trabajo

En nuestro caso

3.3 Compresión isóbara
En el tercer paso, el volumen se reduce a presión constante, lo que da un trabajo equivalente gráficamente al área de un rectángulo
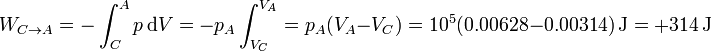
3.4 Trabajo neto
El trabajo neto sobre el gas en el ciclo será la suma de los trabajos individuales

El signo del trabajo nos dice que en realidad es el gas el que realiza el trabajo sobre el ambiente.
4 Energía y calor
La energía interna de un gas ideal depende solamente de su temperatura
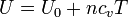
siendo la capacidad calorífica molar para el aire aproximadamente igual a la de un gas diatómico
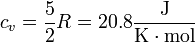
La variación de la energía interna en cualquier proceso es proporcional a la diferencia de temperaturas
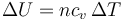
independientemente de si el proceso es a presión constante, a volumen constante o como sea, por tratarse de una función de estado.
Una vez que calculemos la variación en la energía, podemos hallar el calor que entra en el gas por el primer principio de la termodinámica