Compresión lineal
De Laplace
(Diferencias entre revisiones)
(→Representación gráfica) |
|||
| Línea 24: | Línea 24: | ||
==Temperatura final== | ==Temperatura final== | ||
| + | Obtenemos la temperatura final a partir de la ecuación de los gases ideales. Inicialmente tenemos | ||
| + | |||
| + | <center><math>p_0V_0 = n R T_0\qquad\Rightarrow\qquad n R = \frac{p_0V_0}{T_0}</math></center> | ||
| + | |||
| + | En el estado final | ||
| + | |||
| + | <center><math>T = \frac{p V}{n R} = \frac{(2p_0)(V_0/2)}{n R} = \frac{p_0V_0}{n R} = T_0</math></center> | ||
| + | |||
| + | Por tanto, la temperatura final es igual a la inicial. | ||
| + | |||
==Trabajo, energía y calor== | ==Trabajo, energía y calor== | ||
==Temperatura máxima== | ==Temperatura máxima== | ||
==División en dos tramos== | ==División en dos tramos== | ||
[[Categoría:Problemas del gas ideal]] | [[Categoría:Problemas del gas ideal]] | ||
Revisión de 16:40 16 nov 2010
Contenido |
1 Enunciado
Se tiene un volumen V0 de un gas ideal diatómico a una presión p0 y una temperatura T0 encerrado en un recipiente con un pistón móvil. Este gas se comprime reversiblemente según la ley
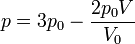
reduciéndose el volumen hasta V0 / 2.
- Trace la gráfica del proceso en un diagrama PV.
- Calcule la temperatura final del proceso.
- Calcule el trabajo neto realizado sobre el gas, la variación de su energía interna y el calor que entra en el gas durante el proceso.
- ¿Para qué volumen durante el proceso la temperatura es máxima? Halle el valor de esta temperatura máxima.
- Separando el proceso en dos: uno hasta que alcanza la temperatura máxima y otro de ahí hasta el final, halle W, ΔU y Q en cada uno de los dos subprocesos.
2 Representación gráfica
Dado que la presión depende del volumen en la forma
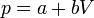
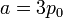

es claro que la gráfica del proceso es un segmento rectilíneo. El punto inicial del segmento es (p0,V0) y el punto final corresponde a V = V0 / 2 y a la presión
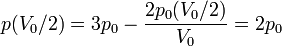
Por tanto el volumen final es la mitad del inicial, mientras que la presión es el doble.
3 Temperatura final
Obtenemos la temperatura final a partir de la ecuación de los gases ideales. Inicialmente tenemos
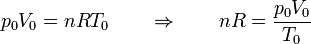
En el estado final
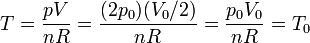
Por tanto, la temperatura final es igual a la inicial.





