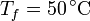Contacto reversible entre dos recipientes
De Laplace
(Página creada con '==Enunciado== Se tienen dos recipientes adiabáticos conteniendo 500 g de agua, a 0°C y 100°C, respectivamente. Se ponen en contacto a través de una pared diate…') |
|||
| Línea 16: | Línea 16: | ||
==Temperatura final (irreversible)== | ==Temperatura final (irreversible)== | ||
| + | Si los dos recipientes se conectan a través de una pared diaterma, se produce una transferencia de calor del más caliente al más frío. La temperatura final la obtenemos imponiendo que no hay intercambio de calor con el exterior, sino que todo el calor que sale del agua caliente va a parar al agua fría y que la temperatura final es la misma para ambos recipientes | ||
| + | |||
| + | <center><math>m_1 c_1 (T_f - T_1) + m_2c_2(T_f-T-2) = 0 \,</math></center> | ||
| + | |||
| + | Puesto que los dos recipientes tienen la misma cantidad de agua y el calor específico es aproximadamente el mismo en los dos casos, obtenemos | ||
| + | |||
| + | <center><math>T_f = \frac{T_1+T_2}{2}</math></center> | ||
| + | |||
| + | esto es, la temperatura final es la media de las dos iniciales. Sustituyendo los valores | ||
| + | |||
| + | <center><math>T_f = 50\,^\circ\mathrm{C}</math></center> | ||
==Calor transferido (irreversible)== | ==Calor transferido (irreversible)== | ||
==variación de entropía== | ==variación de entropía== | ||
Revisión de 14:52 6 sep 2010
Contenido |
1 Enunciado
Se tienen dos recipientes adiabáticos conteniendo 500 g de agua, a 0°C y 100°C, respectivamente.
Se ponen en contacto a través de una pared diaterma. Halle:
- La temperatura final del agua.
- La cantidad de calor transferida.
- La variación de entropía en el proceso.
Suponga ahora que el contacto térmico no se hace directamente sino a través de una máquina térmica reversible que usa los recipientes como foco caliente y foco frío. Teniendo en cuenta que todos los procesos son reversibles:
- Halle la temperatura final del agua
- Calcule el calor cedido por el agua caliente y el absorbido por el agua fría
- Determine el trabajo que se puede extraer del sistema.
2 Temperatura final (irreversible)
Si los dos recipientes se conectan a través de una pared diaterma, se produce una transferencia de calor del más caliente al más frío. La temperatura final la obtenemos imponiendo que no hay intercambio de calor con el exterior, sino que todo el calor que sale del agua caliente va a parar al agua fría y que la temperatura final es la misma para ambos recipientes
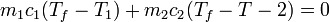
Puesto que los dos recipientes tienen la misma cantidad de agua y el calor específico es aproximadamente el mismo en los dos casos, obtenemos
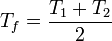
esto es, la temperatura final es la media de las dos iniciales. Sustituyendo los valores