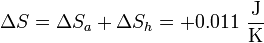Mezcla de agua y hielo
De Laplace
Contenido |
1 Enunciado
Dentro de un recipiente adiabático se sumerge un bloque de 100 g de hielo a 0.0 °C en 1.0 litros de agua a 20 °C. Determine si se funde todo el hielo y la temperatura final del sistema. ¿Qué ocurre si en lugar de 100 g se tiene 1.0 kg de hielo?
¿Cuánta entropía se produce en cada caso?
2 100 g de hielo
Cuando mezclamos dos fases de una misma sustancia a diferentes temperaturas, se produce un flujo de calor desde la de mayor a la de menor temperatura. Este calor, sin embargo, no se traduce necesariamente en un incremento de temperatura, ya que una parte o todo puede emplearse en un cambio de fase.
Para hallar la solución de esta clase de problemas, a menudo es necesario hacer hipótesis sobre cuál será el estado final del sistema que deben ser revisadas posteriormente.
Puesto que el sistema está aislado del exterior, todo el calor es interno, por lo que se cumple la igualdad
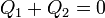
donde llamamos “1” al agua templada y “2” al hielo.
Si la temperatura final del agua es T, el calor que entra en ella (que será negativo, porque en realidad sale) es proporcional a la variación en su temperatura
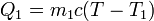
La cantidad máxima de calor que podría pasar del agua 2 al hielo (o agua, posteriormente) 1, lo da el que la temperatura final del agua llegue hasta la del hielo, por debajo de eso nunca podría estar, ya que la temperatura de equilibrio debe ser una intermedia entre las iniciales de las dos partes.
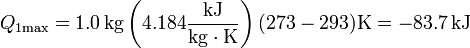
Para el hielo, suponemos que el calor que sale del agua es suficiente para fundirlo por completo y posteriormente incrementar algo su temperatura. Esto es razonable, pues para derretir el hielo necesitamos una cantidad de calor
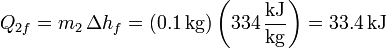
por lo que tenemos de sobra con lo que podemos sacar del agua. En ese caso, el calor total que entra en el hielo será la suma del de fusión más el necesario para elevarlo desde 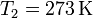 hasta la temperatura final
hasta la temperatura final
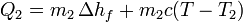
Sumando los dos términos e igualando a cero
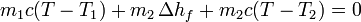
lo que nos da la temperatura final
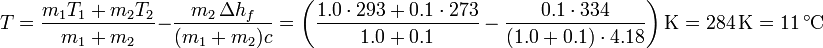
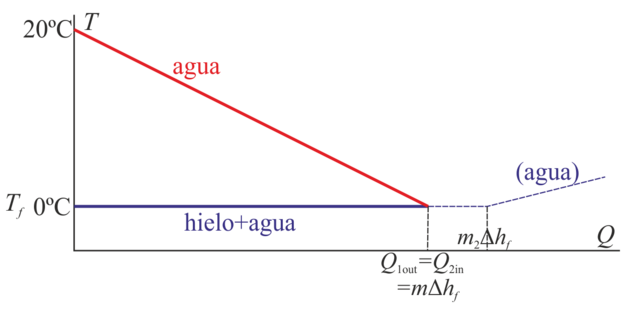
Gráficamente tendríamos una situación como la siguiente:
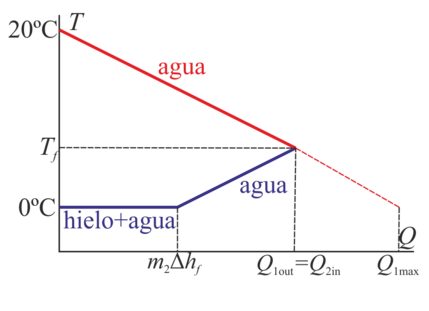
Por un lado tenemos agua que se va enfriando gradualmente desde su temperatura inicial, y por otro inicialmente solo hielo, luego una mezcla saturada de hielo y agua y finalmente, una vez que se ha fundido todo, agua fría que se va calentando.
3 Un kilogramo de hielo
En el segundo caso podríamos aplicar, en principio, la misma fórmula, cambiando solo la masa de hielo
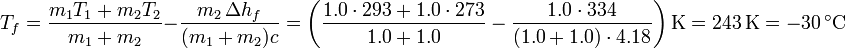
Sin embargo, este resultado es absurdo. No es posible que partiendo de hielo a 0°C y agua a 20°C terminemos con una mezcla a una temperatura inferior a las dos de partida.
El fallo está en suponer que el calor procedente del agua es suficiente para fundir todo el hielo. Como antes, el máximo que podemos sacar del agua antes de que empiece a congelarse es 83.7 kJ, pero ahora se precisan 334 kJ para derretir todo el hielo (pues tenemos 1.0 kg).
Lo que ocurre entonces es que con el calor procedente del agua se funde solo una parte del hielo. Una vez que llega a 0°C el agua alcanza el equilibrio térmico con el hielo y el proceso se detiene. La temperatura final de la mezcla será 0°C. La incógnita es saber cuánto hielo se derrite.
La ecuación para el calor queda en este caso
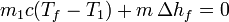
que nos da la masa de hielo que se funde
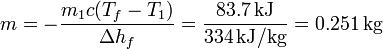
En el estado final tendremos por tanto 749 g de hielo y 1251 g de agua, ambos a 0°C.
La representación gráfica de este proceso sería la siguiente. Por un lado está el agua que se va enfriando y por otro el hielo. La diferencia es que al haber mucho más hielo, se necesita mucho más calor para fundirlo. Por ello, el punto de corte de la recta del agua que cede calor y del hielo que lo absorbe se corta (se alcanza el equilibrio), cuando aun queda hielo. Una vez igualadas las temperaturas cesa el flujo de calor y se detiene el proceso.
4 Producción de entropía
4.1 Cien gramos de hielo
Al bajar la temperatura del agua, desciende su entropía, mientras que la del hielo aumenta.
La variación de entropía de un sólido o líquido cuya temperatura cambia gradualmente es
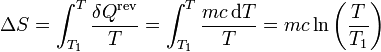
con valor numérico
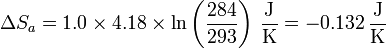
Para el hielo debemos considerar dos contribuciones: una debida al cambio de fase y otra asociada al calentamiento hasta la temperatura final.
El cambio de fase es un proceso isotermo, por lo que
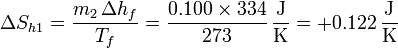
y para el calentamiento posterior empleamos la misma fórmula que para el enfriamiento del agua
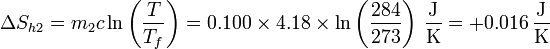
Sumando las dos contribuciones, la variación de entropía del hielo es
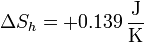
y la variación de entropía del sistema
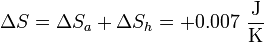
4.2 Un kilogramo de hielo
En el segundo caso, no todo el hielo se transforma en agua y la temperatura final del agua templada es la del punto de fusión.
La variación de entropía del agua inicialmente a 20°C es
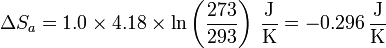
Para el hielo solo debemos considerar la variación de entropía debida a la fusión parcial. Teniendo en cuenta que se derriten 251g de hielo
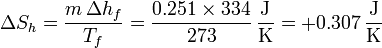
y la variación total de entropía es ahora